微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验中,反应速率加快是由催化剂引起的是( )
A.在炭粉中加入KCl03,点燃时燃烧更为剧烈
B.H2O2中加入少量MnO2,即可迅速放出气体
C.将炭块粉碎成粉末状,可使燃烧更加充分
D.电解水时,加少量硫酸可使电解速率加快
参考答案:A.在炭粉中加入KCl03,点燃时燃烧更为剧烈,是因为氯酸钾分解产生氧气,增大了氧气的浓度,故反应速率加快,故A不符合;
B.H2O2中加入少量MnO2,即可迅速放出气体,是因为MnO2为催化剂,加快了过氧化氢的分解,故B符合;
C.将炭块粉碎成粉末状,可使燃烧更加充分,是增大了接触面积,反应速率加快,故C不符合;
D.电解水时,加少量硫酸可使电解速率加快是因为硫酸是强电解质能增强水的导电能力,故D不符合;
故选B
本题解析:
本题难度:一般
2、选择题 对恒温恒容密闭容器中的可逆反应:A(g)+3B(g) 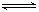 2C(g) ?H <0,下列叙述错误的是
2C(g) ?H <0,下列叙述错误的是
A.升高温度v(正)、v(逆)都增大,但v(逆)增的更大
B.增大压强v(正)、v(逆)都增大,但v(正)增的更大
C.增大A的浓度v(正)会增大,但v(逆)会减小
D.采用正的催化剂一般v(正)、v(逆)同时增大,而且增大的倍数相同
参考答案:C
本题解析:根据方程式可知,正反应是放热反应,所以升高温度,正逆反应速率都是增大的,但逆反应速率增大的更大,平衡向逆反应方向移动,A正确;正反应是体积减小的可逆反应,所以增大压强,正逆反应速率都是增大的,但正反应速率增大的更大,平衡向正反应方向移动,B正确;增大反应物的浓度,正反应速率突然增大,而逆反应速率逐渐增大,平衡向正反应方向移动,C不正确;催化剂是同等程度改变正逆反应速率,选项D正确,答案选C。
本题难度:一般
3、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A.滴加少量CuSO4溶液
B.不用稀硫酸,改用98%的浓硫酸
C.对该反应体系加热
D.不用铁片,改用铁粉
参考答案:A、滴加少量CuSO4溶液,铁置换出Cu,构成Fe、Cu原电池,从而加快了生成氢气的反应速率,故A能;
B、因浓硫酸具有强氧化性,铁与浓硫酸反应生成二氧化硫而不生成氢气,故B不能;
C、因加热时反应体系的温度升高,则化学反应速率加快,故C能;
D、改用铁粉,增大了铁与硫酸反应的接触面积,则反应速率加快,故D能;
故选B.
本题解析:
本题难度:一般
4、填空题 用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答
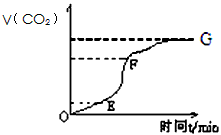
(1)实验过程如下图所示,分析判断:________段化学反应速率最快,_______段收集的二氧化碳气体最多。
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是________________
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(至少回答两种)
________________________。
参考答案:(1)EF;EF
(2)AC
(3)改用较大块的碳酸钙固体;用与盐酸不反应的东西将碳酸钙部分包住(或加入醋酸钠溶液等)
本题解析:
本题难度:一般
5、实验题 I.下列四支试管中,过氧化氢分解的化学反应速率最大的是?
试管
| 温度
| 过氧化氢浓度
| 催化剂
|
a
| 室温(25℃)
| 12%
| 有
|
b
| 水浴加热(50℃)
| 4%
| 无
|
c
| 水浴加热(50℃)
| 12%
| 有
|
d
| 室温(25℃)
| 4%
| 无
|
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
|
(1)实验①和②的目的是____________________________。
(2)写出实验③的化学反应方程式?。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。
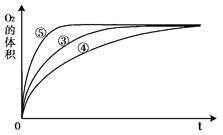
分析上图能够得出的实验结论是?_________________________。
参考答案:I.c(2分)
II.(1)探究浓度对反应速率的影响?(2分)
(2)2H2O2 O2↑+2H2O(2分)
O2↑+2H2O(2分)
(3)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 (2分)
本题解析:I温度越大,化学反应速率越大,催化剂可以提高化学反应的反应速率,所以过氧化氢分解的化学反应速率最大的是c;
II.(1)①和②中所以的过氧化氢的浓度不同,其他条件相同,所以①和②的目的是探究浓度对反应速率的影响;(2)实验③采用了FeCl3作为催化剂,所以实验③的化学反应方程式为2H2O2 O2↑+2H2O;有图可以知道加入少量NaOH溶液,反应很快结束,而加入少量HCl溶液则反应最慢结束,所以分析该图能够得出的结论为碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 。
O2↑+2H2O;有图可以知道加入少量NaOH溶液,反应很快结束,而加入少量HCl溶液则反应最慢结束,所以分析该图能够得出的结论为碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 。
点评:本题通过实验的方式探究了影响化学反应速率的因素,有综合性较好,有利于培养学生的探究性思维,本题难度不大。
本题难度:一般