微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)明矾水溶液呈____性,原因是_?__?;(用离子方程式说明)。碳酸钠水溶液呈____性,原因是_?_? _.(用离子方程式说明)。把上述两溶液混合后呈现的现象有?_,反应现象的离子方程式是?.
_.(用离子方程式说明)。把上述两溶液混合后呈现的现象有?_,反应现象的离子方程式是?.
参考答案:

本题解析:略
本题难度:一般
2、选择题 将下列溶液分别蒸干并灼烧,能得到溶质的是
A.FeCl3
B.AlCl3
C.Na2CO3
D.NaHCO3
参考答案:C
本题解析:A.加热水解平衡 FeCl3+3H2O 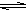 Fe(OH)3+3HCl向正反应方向移动,HCl不断挥发逸出,蒸干得到的固体是Fe(OH)3。灼烧Fe(OH)3发生分解反应:2 Fe(OH)3
Fe(OH)3+3HCl向正反应方向移动,HCl不断挥发逸出,蒸干得到的固体是Fe(OH)3。灼烧Fe(OH)3发生分解反应:2 Fe(OH)3 Fe2O3+3H2O.最后得到的固体是Fe2O3,不是原来的溶质。错误。B.AlCl3加热水解平衡 AlCl3+3H2O
Fe2O3+3H2O.最后得到的固体是Fe2O3,不是原来的溶质。错误。B.AlCl3加热水解平衡 AlCl3+3H2O 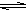 Al(OH)3+3HCl向正反应方向移动,HCl不断挥发逸出,蒸干得到的固体是Al(OH)3。灼烧Al(OH)3发生分解反应:2 Al(OH)3
Al(OH)3+3HCl向正反应方向移动,HCl不断挥发逸出,蒸干得到的固体是Al(OH)3。灼烧Al(OH)3发生分解反应:2 Al(OH)3  Al2O3+3H2O.最后得到的固体是Al2O3,不是原来的溶质。错误。C.加热水解平衡Na2CO3+H2O
Al2O3+3H2O.最后得到的固体是Al2O3,不是原来的溶质。错误。C.加热水解平衡Na2CO3+H2O 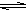 NaOH+NaHCO3向正反应方向移动。随着不断的加热,水分不断蒸发,但NaOH无挥发性,会发生反应NaOH+NaHCO3=Na2CO3+H2O。最后蒸干得到固体Na2CO3。Na2CO3热稳定性强,灼烧不分解,所以蒸干并灼烧,能得到原来的溶质。正确。D.加热水解平衡NaHCO3+H2O
NaOH+NaHCO3向正反应方向移动。随着不断的加热,水分不断蒸发,但NaOH无挥发性,会发生反应NaOH+NaHCO3=Na2CO3+H2O。最后蒸干得到固体Na2CO3。Na2CO3热稳定性强,灼烧不分解,所以蒸干并灼烧,能得到原来的溶质。正确。D.加热水解平衡NaHCO3+H2O 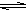 NaOH+H2CO3向正反应方向移动,随着水分的挥发,溶液的浓度逐渐增大,发生反应NaOH+H2CO3=NaHCO3+H2O。蒸干得到的固体是NaHCO3。灼烧时发生反应:2 NaHCO3
NaOH+H2CO3向正反应方向移动,随着水分的挥发,溶液的浓度逐渐增大,发生反应NaOH+H2CO3=NaHCO3+H2O。蒸干得到的固体是NaHCO3。灼烧时发生反应:2 NaHCO3 Na2CO3+H2O+ CO2↑.最后得到的固体是Na2CO3,不是原来的溶质。错误。
Na2CO3+H2O+ CO2↑.最后得到的固体是Na2CO3,不是原来的溶质。错误。
本题难度:一般
3、选择题 根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
化学式
| 电离常数
|
HClO
| K=3×10-8
|
H2CO3
| K1=4.3×10-7
|
K2=5.6×10-11
|
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+ c(CO32-) + c(H2CO3) +c(ClO-) +c(HClO)
参考答案:A
本题解析:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-) + 2c(CO32-)
c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+ c(CO32-)
2c(Na+)=c(HCO3-)+ c(CO32-) + c(H2CO3) +c(ClO-) +c(HClO)
本题难度:简单
4、选择题 温度相同,浓度均为0.2 molL-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是
A.③①④②⑤
B.①③⑤④②
C.③②①⑤④
D.⑤②④①③
参考答案:A
本题解析:
正确答案:A
⑤呈碱性,pH最大②中性,③①④呈酸性,③NH4HSO4酸性最强,①(NH4)2SO4中NH4+?浓度比④NH4NO3大,酸性强,pH由小到大的排列③①④②⑤
本题难度:一般
5、选择题 为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH,正确的是(?)
A.①②
B.③
C.③④
D.④
参考答案:B
本题解析:在溶液中NH4Cl=NH4++Cl-. 由于发生水解反应:NH4++ H2O NH3·H2O+ H+。所以c(Cl-)>c(NH4+)。为了使溶液中NH4+浓度与Cl-的浓度比为1:1,应该加入物质来抑制该水解反应的进行。①适量的HCl,平衡逆向移动,c(NH4+)增大,都是c(Cl-)也增大,所以仍然是c(Cl-)>c(NH4+)。错误。②适量的NaCl,由于溶液的稀释作用,NH4+水解程度增大,c(NH4+)减小,c(Cl-)增大,所以仍然是c(Cl-)>c(NH4+)。错误。③适量的氨水NH3·H2O电离产生NH4+,使c(NH4+)增大,Cl-则由于氨水的稀释作用c(Cl-)减小。因此可以形成NH4+浓度与Cl-的浓度比为1:1的溶液。正确。④适量的NaOH,OH-会消耗H+,使NH4+水解程度增大,c(NH4+)进一步减小,NH4+浓度与Cl-的浓度比比1:1更小。错误。
NH3·H2O+ H+。所以c(Cl-)>c(NH4+)。为了使溶液中NH4+浓度与Cl-的浓度比为1:1,应该加入物质来抑制该水解反应的进行。①适量的HCl,平衡逆向移动,c(NH4+)增大,都是c(Cl-)也增大,所以仍然是c(Cl-)>c(NH4+)。错误。②适量的NaCl,由于溶液的稀释作用,NH4+水解程度增大,c(NH4+)减小,c(Cl-)增大,所以仍然是c(Cl-)>c(NH4+)。错误。③适量的氨水NH3·H2O电离产生NH4+,使c(NH4+)增大,Cl-则由于氨水的稀释作用c(Cl-)减小。因此可以形成NH4+浓度与Cl-的浓度比为1:1的溶液。正确。④适量的NaOH,OH-会消耗H+,使NH4+水解程度增大,c(NH4+)进一步减小,NH4+浓度与Cl-的浓度比比1:1更小。错误。
本题难度:一般