微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 “比较”是化学研究的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应.
如:2Na2O+2CO2═2Na2CO3+O2,Na2O2+CO═Na2CO3
(1)试分别写出Na2O2与SO2、Na2O2与SO3(g)反应的化学方程式:______、______
(2)当1mol?SO3(g)参加反应时,转移电子的物质的量为______mol.
(3)通过比较可知:在氧化物中,当非金属元素处于______(填“最低”、“中间”或“最高”)价时,其氧化物与过氧化钠反应就有O2生成.
参考答案:(1)根据根据过氧化钠和二氧化碳的反应,可以推知过氧化钠和二氧化硫反应生成亚硫酸钠和氧气,亚硫酸钠易被氧气氧化为硫酸钠,即SO2+Na2O2=Na2SO4,三氧化硫和过氧化钠反应生成硫酸钠和氧气,
即2SO3+2Na2O2=2Na2SO4+O2,故答案为:2Na2O2+2SO2═2Na2SO4;2Na2O2+2SO3═2Na2SO4+O2;
(2)根据反应2Na2O2+2SO3═2Na2SO4+O2,该反应中化合价升高值=化合价降低值=2,即转移电子数为2,
所以当1mol?SO3(g)参加反应时,转移电子的物质的量为1mol,故答案为:1;
(3)根据反应2Na2O+2CO2═2Na2CO3+O2,Na2O2+CO═Na2CO3和2Na2O2+2SO2═2Na2SO4,2Na2O2+2SO3═2Na2SO4+O2,比较可知:在氧化物中,当非金属元素处于最高价时,其氧化物与过氧化钠反应就有O2生成,故答案为:最高.
本题解析:
本题难度:一般
2、选择题 在下列反应中,氧化剂与还原剂的质量之比为1:1的是( )
A.2FeCl2+Cl2═2FeCl3
B.3Cl2+6NaOH═5NaCl+NaClO+3H2O
C.Cl2+2NaOH═NaCl+NaClO+H2O
D.3NO2+H2O═2HNO3+NO
参考答案:A.2FeCl2+Cl2═2FeCl3中,铁元素的化合价升高,氯元素的化合价降低,所以氯化亚铁是还原剂,氯气是氧化剂,氧化剂和还原剂的物质的量之比是1:2,故A错误;
B.3Cl2+6NaOH═5NaCl+NaClO+3H2O中,氯元素的化合价有升高的,有降低的,所以氯气既是氧化剂又是还原剂,升高的和降低的氯原子个数之比是1:5,所以氧化剂和还原剂的物质的量之比是5:1,故B错误;
C.Cl2+2NaOH═NaCl+NaClO+H2O中,氯元素的化合价有升高的,有降低的,所以氯气既是氧化剂又是还原剂,降低的和升高的氯原子个数之比是1:1,所以氧化剂和还原剂的物质的量之比是1:1,故C正确;
D.3NO2+H2O═2HNO3+NO中,氮元素的化合价有升高的有降低的,所以二氧化氮既是氧化剂又是还原剂,
降低的和升高的氮原子个数之比是1:2,所以氧化剂和还原剂的物质的量之比是1:2,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 高铁酸钾?(K2FeO4)是一种高效绿色水处理剂,其工业制备的反应原理为:2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O,下列说法正确的是( )
A.制高铁酸钾用KClO做还原剂
B.KCl是还原产物
C.高铁酸钾中铁的化合价为+7
D.制备高铁酸钾时1molFe?(OH)3得到3?mol电子
参考答案:A.反应2Fe(OH)3+3KClO+4KOH=2K2FeO4+3KCl+5H2O中,Cl元素的化合价由+1价降低为-1价,则KClO为氧化剂,Fe(OH)3为还原剂,故A错误;
B.次氯酸钾是氧化剂,则氯化钾是还原产物,故B正确;
C.高铁酸钾中铁元素的化合价是+6价,故C错误;
D.因反应中铁元素的化合价由+3价升高到+6价,则1molFe(OH)3失去3mol电子,故D错误;
故选B.
本题解析:
本题难度:一般
4、选择题 在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )
A.FeCl3
B.FeCl2
C.S
D.HCl
参考答案:这几种物质中化合价变化的元素是S和Fe元素,H2S中S的化合价是-2价,S中S的化合价是0价,FeCl3中Fe的化合价是+3价,FeCl2中Fe的化合价是+2价,H2S为反应物,失电子化合价升高生成S单质,则另一种物质必须是得电子化合价降低,所以另一种反应物是FeCl3,故选A.
本题解析:
本题难度:简单
5、简答题 某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2?只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:______(填序号).
A.盐酸 ?B.浓硫酸 ? C.稀硫酸 ? D.醋酸.
(2)该反应中发生还原反应的过程是:______→______.
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:______
(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为______mol.
(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为______.
(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是______.
参考答案:(1)这是MnO4-酸性环境下氧化H2O2的反应,
A、盐酸也会被MnO4-氧化,故A错误;
B、浓硫酸没有必要,这里主要利用硫酸的酸性就可以了,不需要浓硫酸,浓硫酸是利用它的吸水性、强氧化性等情况才用的,故B错误;
C、稀硫酸可以提供酸性环境并且不易被高锰酸根氧化,故C正确;
D、醋酸酸性弱,还可能被MnO4-氧化,故D错误.
故选C.
(2)该反应过程中,MnO4-的Mn元素化合价降低,在反应中被还原生成Mn2+,发生还原反应,
故答案为:MnO4-;Mn2+;
(3)该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应,
即2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,在该反应中,化合价升高值=化合价降低值=转移电子数=10,
电子转移情况如下:
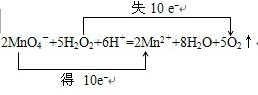
,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,

;
(4)上述反应中生成5mol氧气转移电子10mol,当反应中有6.72L(标准状况)即0.3mol氧气生成时,则转移的电子为0.6mol,故答案为:0.6;
(5)反应KCN+H2O2+H2O═A+NH3↑中,根据原子守恒可知生成物A的化学式为KHCO3,故答案为:KHCO3;?
(6)H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性,所以H2O2被称为绿色氧化剂,
故答案为:H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性.
本题解析:
本题难度:一般