微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
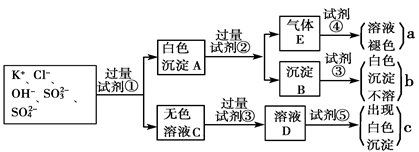
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。
参考答案:(1) BaSO3 + 2H+  Ba2+ + SO2↑ + H2O (2分)
Ba2+ + SO2↑ + H2O (2分)
(2) 中和OH-,防止对Cl-的检验产生干扰(2分)
(3) 会使SO32-对SO42-的检验产生干扰,不能确定SO42-和SO32-是否存在(2分)
(4) SO2 + Br2 + 2H2O  4H+ + SO42- + 2Br-(2分)
4H+ + SO42- + 2Br-(2分)
本题解析: 亚硫酸根离子和硫酸根离子都可以与钡离子反应生成白色沉淀,而亚硫酸钡沉淀不溶于水但能溶解在酸中,但硫酸钡沉淀既不溶解在水中,也不溶解在酸中。亚硫酸根离子在硝酸溶液中会被氧化为硫酸根离子,因此要检验硫酸根离子的存在时要先排除掉亚硫酸根离子对其的干扰,因此加的试剂1应为盐酸,
考点:
本题难度:困难
2、选择题 某无色溶液中能大量共存的一组离子是
[? ]
A.H+、Ba2+、HCO3-、Cl-?
B.K+、Fe3+、I-、NO3-
C.NH4+、Al3+、Cl-、NO3-?
D.Mg2+、SO42-、SiO32-、H+
参考答案:C
本题解析:
本题难度:一般
3、选择题 在检验SO42-的过程中,下列操作中正确的是
A.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
B .先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在
C.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
D.先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
参考答案:A
本题解析:检验SO42-的正确操作是先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生实验能力的培养,该题的关键是要注意排除其它离子的干扰,有利于培养学生规范、严谨的实验设计能力。
本题难度:简单
4、选择题 已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。 如果分别用相同物质的量的这些物质氧化足量的KI,得到I2最多的是
A.Fe3+
B.MnO4-
C.Cl2
D.HNO3
参考答案:B
本题解析:由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
A、1molFe3+→Fe2+得1mole-,
B、1molMnO4-→Mn2+得5mole-,
C、1molCl2→2Cl-得2mole-,
D、1molHNO3→NO得1mole-。
显然B中1mol氧化剂得电子最多,生成的I2就最多。
故选B。
点评:本题考查了氧化还原反应中电子守恒规律,同时要求学生具有分析和解决问题的能力。
本题难度:简单
5、选择题 在由水电离产生的H+浓度为1×10-13 mol/L的溶液中,一定能大量共存的离子组是
[? ]
①K+、Cl-、NO3-、S2-; ②K+、Fe2+、I-、SO42-;
③Na+、Cl-、NO3-、SO42-;④Na+、Ca2+、Cl-、HCO3-
⑤K+、Ba2+、Cl-、NO3-
A.①③
B.③⑤
C.③④
D.②⑤
参考答案:B
本题解析:
本题难度:一般