微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知:A、B、C、D为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;D的基态原子的M电子层上有4个未成对电子。
请回答下列问题:
(1)D是元素周期表中第________周期,第________族的元素;其基态原子的外围电子排布式为________。
(2)A、B、C、D四种元素中,电负性最大的是________(填元素符号)。
(3)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为________。B的氢化物的沸点远高于A的氢化物的沸点的主要原因是________________________________________________________________。
(4)D能与AC分子形成D(AC)5,其原因是AC分子中含有________________。D(AC)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断D(AC)5晶体属于________(填晶体类型)。
(5)SiO2的晶胞可作如下推导:先将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成Si原子,再在每两个不共面的“小立方体”中心处各放置一个Si原子便构成了晶体Si的一个晶胞。再在每两个相邻的Si原子(距离最近的两个Si原子)中心连线的中点处增添一个O原子,便构成了SiO2晶胞,故SiO2晶胞中有________个Si原子,________个O原子。
参考答案:(1)四 Ⅷ 3d64s2 (2)O (3)sp NH3分子间能形成氢键
(4)孤电子对 分子晶体
(5)8 16
本题解析:本题以原子结构的特点为元素推断的核心,综合考查了电负性、等电子体、配合物理论以及晶体结构等。由A的基态原子有3个不同的能级,各能级中电子数相等,可知A的基态原子电子排布式为1s22s22p2,为碳元素;由C的基态原子2p能级上的未成对电子数与A原子相同,为2个,故其基态原子电子排布式为1s22s22p4,为氧元素,依据A、B、C的原子序数逐渐增大可知B为氮元素;由D的基态原子的M电子层上有4个未成对电子,可知其基态原子电子排布式为[Ar]3d64s2,为铁元素。
(3)OCN-的中心原子C原子的孤电子对数为0,故采取sp杂化。氨气的沸点远高于甲烷的沸点是因为前者形成氢键。
(5)一个氯化钠晶胞中含4个钠离子及4个氯离子,含有8个“小立方体”,每个不共面的“小立方体”中心处放置一个Si原子,故一个SiO2的晶胞中含有8个Si原子,而硅原子和氧原子个数比为1∶2,故含16个O原子。
本题难度:困难
2、选择题 下列含有非极性键的共价化合物是
[? ]
A.HCl
B.Na2O2
C.C2H2
D.CH4
参考答案:C
本题解析:
本题难度:简单
3、填空题 A、B、C、D是同一周期的四种元素。A、B、C的原子序数依次相差1。A元素的单质的化学性质活泼,A元素的原子在本周期中原子半径最大,B元素的氧化物2.0g恰好跟100mL0.50mol/L硫酸完全反应,B元素单质跟D元素单质反应生成化合物BD2。根据以上事实填写下列空白:
(1)A的原子结构示意图___________;C原子的电子排布式_________________;BD2的电子式_______________。
(2)四种元素原子第一电离能的大小顺序为_________________(用元素符号表示);四种元素原子半径的大小顺序为_______________________(用元素符号表示);四种元素简单离子的离子半径大小顺序为___________________(用离子符号表示)。
参考答案:(1)“略”
(2)Cl>Mg>Al>Na
(3)Na>Mg>Al>Cl
(4)Cl->Na+>Mg2+>Al3+
本题解析:
本题难度:一般
4、选择题 对σ键和π键的认识不正确的是( )
A.σ键和π键不属于共价键,是另一种化学键
B.s-sσ键与s-pσ键的电子云均为轴对称图形
C.分子中含有共价键,则至少含有一个σ键
D.含有π键的化合物与只含σ键的化合物的化学性质不同
参考答案:A
本题解析:
本题难度:一般
5、选择题 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱。(如下表)
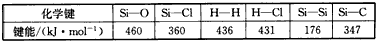
下列说法中错误的是
[? ]
A.SiCl4(g)+2H2(g)=Si(s)+4HCl(g)反应热△H为236kJ/mol
B.拆开1mol晶体硅中的化学键所吸收的能量为176kJ
C.HCl的熔点比H2高
D.C-C的键能大于Si-Si
参考答案:B
本题解析:
本题难度:一般