微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 两种大气污染物NO2和SO2在一定条件下可发生如下反应:NO2 + SO2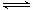 NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为(? )
NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为(? )
A.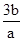
B.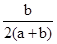
C.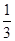
D.
参考答案:B
本题解析:根据质量守恒定律知,反应后容器内硫原子的物质的量n(S)=n(SO2)=bmol,氧原子的物质的量n(O)=2n(NO2)+2n(SO2)=2amol+2bmol,反应后容器内硫原子和氧原子个数比为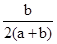 ,选B。
,选B。
本题难度:一般
2、填空题 (6分)某硫酸厂以硫铁矿为原料生产硫酸,主要过程的化学反应情况如下:
生产过程
| 化学反应
| 反应情况
|
硫铁矿的燃烧
| 4?+11O2 2Fe2O3+8SO2 2Fe2O3+8SO2
| 4%的硫元素损失而混入炉渣
|
SO2的接触氧化
| 2SO2+O2 2SO3 2SO3
| SO2转化率为95%
|
SO3的吸收
| SO3+H2O=H2SO4
| SO3的吸收率为98%
|
?(1)将硫铁矿燃烧的化学方程式补充完整:4?+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)该厂现用100吨含硫40%的硫铁矿生产硫酸,可生产98%的浓H2SO4多少吨?(除上述硫的损失外,忽略其它损失)
参考答案:(1)FeS2(2分)? (2)111.72吨(4分)
本题解析:略
本题难度:一般
3、选择题 铜与浓硫酸反应时,当转移了0.2mol电子时,消耗的硫酸有
A.0.1mol
B.0.2mol
C.0.4mol
D.0.05mol
参考答案:B
本题解析:转移了0.2mol电子时消耗的铜单质有0.1mol,根据电子守恒则产生的二氧化硫为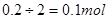 ,反应生成的硫酸铜有0.1mol,总共产物中的硫元素有0.1+0.1=0.2mol.根据硫元素守恒反应物中的硫酸有0.2mol,所以答案选B。
,反应生成的硫酸铜有0.1mol,总共产物中的硫元素有0.1+0.1=0.2mol.根据硫元素守恒反应物中的硫酸有0.2mol,所以答案选B。
本题难度:一般
4、实验题 ( 6分)如右图。在一支试管中放入一小块铜片,再加入少量浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花。给试管加热,观察现象。当试管中的液体逐渐透明时,停止加热。

回答下列问题:
(1)试管中的液体反应一段时间后,b处滤纸条的变化为?_。
待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为?。
(2)待试管中的液体冷却后,将试管上层液体倒去,再慢慢加入少量水,可观察溶液呈??色。
(3)玻璃导管口蘸有Na2CO3溶液的棉花所起的作用是?,有关反应的化学方程式为?。
参考答案:

本题解析:略
本题难度:一般
5、实验题 用下图所示装实验置进行铜与浓硫酸反应的实验探究,请回答下列问题:
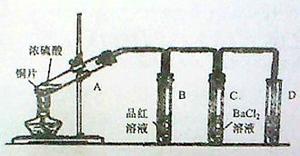
(1)试管A中发生反应的化学方程式为?。
(2)试管B中的实验现象是?,将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是?。
(3)反应一段时间后,试管C中没有观察到沉淀生成,若往试管C中通入或加入一种物质X,即生成白色沉淀,该物质X不可能是下列的?。(填序号)
a、 ? b、
? b、 ? c、
? c、 ? d、
? d、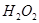
(4)试管A中的铜和硫酸充分反应后,铜和硫酸都有剩余,下列物质中能使试管A中的铜片继续溶解的是?。(填序号)
a、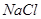 ? b、
? b、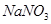 ? c、
? c、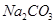 ? d、
? d、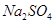
(5)试管D中的试剂是?溶液,其作用是?。
参考答案:(13分)(1)Cu+2H2SO4(浓)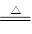 CuSO4+2H2O+SO2↑(3分)
CuSO4+2H2O+SO2↑(3分)
(2)品红溶液褪色;品红溶液又恢复为原来的颜色
(3) c?;(4) b?;(5)? NaOH溶液;吸收二氧化硫气体
本题解析:(1)浓硫酸具有强氧化性,能氧化金属铜,则试管A中发生反应的化学方程式为Cu+2H2SO4(浓)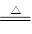 CuSO4+2H2O+SO2↑。
CuSO4+2H2O+SO2↑。
(2)SO2具有漂白性,则试管B中的实验现象是品红溶液褪色;由于SO2的漂白性是不稳定的,则在加热的条件下又恢复到原来的颜色,则将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是品红溶液又恢复为原来的颜色。
(3)SO2溶于水生成亚硫酸,溶液显酸性,得不到亚硫酸钡白色沉淀。因此要生成白色沉淀则可以加入氧化剂或碱性气体,即选项abd都可以,其中ad生成的是硫酸钡白色沉淀,c是的亚硫酸钡白色沉淀,答案选b。
(4)在酸性条件下,硝酸盐具有强氧化性,能氧化单质铜,因此加入的物质是硝酸钠,答案选b。
(5)SO2是大气污染物,应该用氢氧化钠溶液吸收,防止污染空气。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,也有助于调动学生的学习兴趣和学习积极性。
本题难度:一般