微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 物质X是某反应中的生成物,其质量先增大后减小,下列各操作中指定物质数量变化符合此特征的是
A.A
B.B
C.C
D.D
参考答案:A
本题解析:分析:A、向NaClO溶液中通入SO2,生成的Na2SO3质量增大,继续通入生成亚硫酸氢钠;
B、向Na2CO3溶液中滴加盐酸,反应过程中氯化钠质量增多;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变.
解答:A、向NaClO溶液中通入SO2,生成的Na2SO4,继续通入质量不变,故A不符合;
B、向Na2CO3溶液中滴加盐酸,生成碳酸氢钠和氯化钠,继续滴加反应过程中氯化钠质量增多,故B不符合;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小,故C符合;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变,故D不符合;
故选C.
点评:本题考查了钠及其化合物性质的应用,注意反应过程中量不同产物不同,物质性质是解题的关键,题目难度中等.
本题难度:一般
2、选择题 俗名和化学式符合的是
①纯碱 NaCl? ②苛性钠 Na?
③苏打 NaHCO3? ④烧碱?NaOH
⑤芒硝 Na2SO4·10H2O
A.①②
B.③④
C.②③
D.④⑤
参考答案:D
本题解析:记清某些物质的俗名是解答本题的关键。纯碱是Na2CO3,火碱、烧碱、苛性钠都是NaOH,苏打是Na2CO3,小苏打是NaHCO3。
本题难度:一般
3、选择题 光导纤维的主要成分是
A.硅
B.玻璃
C.二氧化硅
D.沙子
参考答案:C
本题解析:正确答案:C
光导纤维的主要成分是SiO2,SiO2具有良好的导光性,原理:光能够在玻璃纤维或塑料纤维中传递是利用光在折射率不同的两种物质的交界面处产生“全反射”作用的原理。
本题难度:一般
4、选择题 0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的物质的量浓度之比为
A.5:2
B.3:1
C.15:2
D.5:2
参考答案:B
本题解析:试题分析:浓度与体积无关。两溶液中Cl-浓度比为1×3:1×1。
考点:物质的量浓度计算
点评:浓度与体积无关。
本题难度:困难
5、选择题 某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
A.根据表中数据不能计算出混合物中NaHCO3的质量分数
B.加入混合物9.2 g时盐酸过量
C.盐酸的物质的量浓度为3.0mol·L-1
D.15.7 g混合物恰好与盐酸完全反应
参考答案:AD
本题解析:9.2g混合物与50mL盐酸反应生成2.24L CO2,则生成3.36L CO2气体需混合的质量为13.8 g,所以D错误,同时可知B正确;根据第一组数据50mL盐酸与9.2g混合物反应生成2.24L CO2,可计算出NaHCO3的质量分数,解题过程如下:
设:9.2g混合物中NaHCO3的物质的量为x,KHCO3的物质的量为y
则:84x+100y=9.2
X+y=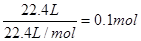 得x="0.05mol" ; y=0.05mol进而可求NaHCO3的质量分数,所以A错;根据第二组数据50mL盐酸与15.7g混合物反应生成3.36L CO2,且混合物过量,即盐酸完全反应,根据离子方程式:H++HCO3-=CO2↑+H2O,HCL与CO2的关系为1:1可知HCL的物质的量为0.15mol,即可求得盐酸的物质的量浓度为3.0mol·L-1
得x="0.05mol" ; y=0.05mol进而可求NaHCO3的质量分数,所以A错;根据第二组数据50mL盐酸与15.7g混合物反应生成3.36L CO2,且混合物过量,即盐酸完全反应,根据离子方程式:H++HCO3-=CO2↑+H2O,HCL与CO2的关系为1:1可知HCL的物质的量为0.15mol,即可求得盐酸的物质的量浓度为3.0mol·L-1
本题难度:简单