微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 [化学——选修物质结构与性质](15分)
A、B、C、D是原子序数依次递增的短周期元素,四种元素的质子数之和小于23。
A元素原子的电子总数等于其基态原子的电子层数。B元素原子的价电子结构为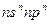 。C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但
。C元素的第一电离能在同族元素中最大,并且高于同周期左右相邻的元素,但
其单质的熔点却低于同周期左右相邻元素的单质。D的电负性大于C。
(1)B、C、D分别是?、?、?;
(2)C、D分别与A形成的最简单分子中,稳定性较高的是?(填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会发生改变,其原因是?。
(3)BD2分子的晶体结构为密堆积,则每个BD2分子周围紧邻的分子有?个;
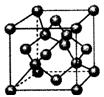
(4)上图为B元素的某种单质晶体X的晶胞,其中含有?个B原子,该晶体?
(填“形成”或“没有形成”)最密堆积结构,原因是?。试分析比较晶体X与晶体BD2的熔点?。
参考答案:
(1)C、N、O(或碳、氮、氧)(每空1分)
(2)H2O(1分);H2O呈V形(键角约104.5°),H2O与H′形成配位键后,氧原子上
的孤对电子由两对变为一对,H—O——H的键角变大,H3O+呈三角锥形(或用杂化轨
道理解释)(2分)
(3)12(2分)
(4)8(2分);没有形成(1分);金刚石中每个碳原子以四个共价单键对称的与相邻的4个碳原子结合,C—C—C夹角为109°28′,形成空间网状结构(或答共价键具有方向性和饱和性)(2分);金刚石晶体是原子晶体,由固态转变为液态过程中要破坏共价键,所以熔点较高,干冰是分子晶体,由固态转变成液态过程中只破坏范德华力,所以熔点较低(2分)
本题解析:略
本题难度:一般
2、推断题 下列各物质的转化关系如下图所示,其中A是一种高熔点固体,D是一种红棕色固体。
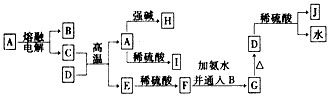
回答下列问题:
(1)C的化学式为___________;J的化学式为____________。
(2)写出A与NaOH溶液反应生成H的离子方程式:______________________。
(3)写出C和D反应的化学方程式:________________________。
(4)从F到G的实验现象为_________________________。
参考答案:(1)A1;Fe2(SO4)3
(2)Al2O3+2OH- = 2A1O2- +H2O
(3)
(4)先产生白色沉淀,很快白色沉淀变成灰绿色,最终变成红褐色
本题解析:
本题难度:一般
3、推断题 如下图所示,已知:①单质E可作为半导体材料;②化合物F是不能生成盐的氧化物;③化合物I能溶于水,其水溶液呈酸性,它能跟氧化物A发生反应。据此填空。
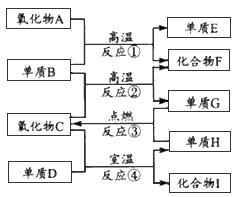
(1)化合物F是___。
(2)化合物I是___。
(3)反应③的化学方程式是____。
(4)反应④的化学方程式是________。
参考答案:(1)CO
(2)HF
(3)2H2+O2 2H2O
2H2O
(4)2F2 +2H2O=4HF+O2
本题解析:
本题难度:一般
4、简答题 如图是由一些常见元素组成的单质及其化合物之间的转化关系图.常温常压下,D、F均为无色无味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体;G是一种红褐色沉淀,且G、H、I、J中都含有同一种元素(反应中生成的部分物质已略去).请回答下列问题:
(1)从反应②的实验现象可以得出物质C具有的某些物理性质有(写两点):______.
(2)J暴露在空气中的现象是______.
(3)①--⑦的反应中属于非氧化还原反应的有______.
(4)反应①的化学方程式为______.
(5)将115g甲酸(HCOOH)完全燃烧后的产物通过足量的固体A中,固体A将增重______g.
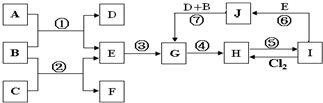
参考答案:A是由单质C在D中燃烧生成的淡黄色固体,应为Na2O2,B是最常见的无色液体,应为H2O,则D为O2,E为NaOH,C为Na,F为H2,G是一种红褐色沉淀,为Fe(OH)3,且G、H、I、J中都含有同一种元素,由转化关系可知,都含有Fe元素,由反应⑦可知,J为Fe(OH)2,I与与NaOH反应得到J、氯气反应得到H,可推知I为FeCl2,H为FeCl3,
(1)反应②是Na与水反应,从实验现象可以得出物质Na具有的某些物理性质:银白色金属、固体、密度比水小、熔点低等,
故答案为:银白色金属、固体、密度比水小、熔点低等;
(2)J是Fe(OH)2,暴露在空气中被氧化生成Fe(OH)3,现象是:白色固体迅速变成灰绿色,最后变成红褐色,
故答案为:白色固体迅速变成灰绿色,最后变成红褐色;
(3)反应①过氧化钠与水反应生成氢氧化钠与氧气,属于氧化还有反应,反应②是Na与水生成氢氧化钠与氢气,是置换反应,属于氧化还有反应,反应⑤是氯化铁反应生成氯化亚铁,属于氧化还原反应,反应⑦是氢氧化亚铁氧化生成氢氧化铁,属于氧化还原反应,
反应③是氢氧化钠与铁盐反应生成氢氧化铁,属于非氧化还原反应,反应④是氢氧化铁与盐酸反应生成氯化铁与水,属于非氧化还原反应,反应⑥是氯化亚铁与氢氧化钠反应生成氢氧化亚铁,属于非氧化还原反应,
故答案为:③④⑥;
(4)反应①的化学方程式为:2Na2O2+2H2O=2NaOH+O2↑,故答案为:2Na2O2+2H2O=2NaOH+O2↑;
(5)将115g甲酸(HCOOH)的物质的量=115g46g/mol=2.5mol,完全燃烧生成2.5molCO2,2.5molH2O,通过足量的固体Na2O2中,发生反应2Na2O2+2CO2=2Na2CO3+O2↑,固体增重相当于与CO2等物质的量的CO的质量,发生反应:2Na2O2+2H2O=2NaOH+O2↑,固体增重相当于与H2O等物质的量氢气的质量,故过氧化钠增重=2.5mol×28g/mol+2.5mol×2g/mol=75g,
故答案为:75.
本题解析:
本题难度:简单
5、简答题 甲、乙、丙、丁、戊几种中学常见的物质在常温有如图转化关系,在转化过程中,乙与KHCO3按等物质的量混合,并且恰好完全反应.
(1)若甲是一种金属单质,其焰色与丁的焰色一样均为黄色,则各种物质化学式为:
甲:______乙:______丙:______丁:______戊:______;反应①的化学方程式为:______.
(2)若甲是一种黄绿色的气体单质,丁为一种盐,则各种物质的化学式为:
甲______乙:______丙:______丁:______戊:______;反应②的离子方程式为:______.
(3)若甲是一种氧化物,丙可以使带火星的木条复燃,戊的焰色为黄色,则各物质的
化学式为:甲:______乙:______丙:______丁:______戊:______;
反应①的化学方程式为:______;
反应②的离子方程式为:______.
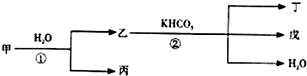
参考答案:(1)若甲为金属单质,则甲为Na,丙为H2,乙为NaOH,甲的焰色与丁的焰色一样均为黄色,则丁为Na2CO3,戊为K2CO3,符合上述转化,反应①为2Na+2H2O=2NaOH+H2↑,故答案为:Na;NaOH;H2;Na2CO3;K2CO3;2Na+2H2O=2NaOH+H2↑;
(2)若甲是一种黄绿色的气体单质,则甲为Cl2,乙为HCl,丙为HClO,丁为一种盐,丁为KCl,戊为CO2,反应②的离子方程式为H++HCO3-=H2O+CO2↑,
故答案为:Cl2;HCl;HClO;KCl;CO2;H++HCO3-=H2O+CO2↑;
(3)若甲是一种氧化物,丙可以使带火星的木条复燃,戊的焰色为黄色,则甲为Na2O2,丙为O2,乙为NaOH,戊为Na2CO3,丁为K2CO3,反应①的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,反应②的离子方程式为OH-+HCO3-=H2O+CO32-,
故答案为:Na2O2;NaOH;O2;K2CO3;Na2CO3;2Na2O2+2H2O=4NaOH+O2↑;OH-+HCO3-=H2O+CO32-.
本题解析:
本题难度:一般