微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是( )
A.8HCl+K2Cr2O7====2KCl+Cr2O3+4H2O+3Cl2↑
B.16HCl+3KMnO4====2MnCl2+8H2O+2KCl+5Cl2↑
C.4HCl+MnO2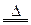 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.6HCl+KClO3====KCl+3H2O+3Cl2↑
参考答案:A
本题解析:根据上述反应可知制取等量的氯气时消耗盐酸的物质的量的大小关系为D>C>B>A。?
本题难度:一般
2、选择题 下列有关氯水的叙述正确的是( )
A.新制氯水中只含有Cl2和H2O
B.新制氯水使蓝色石蕊试纸只变红
C.液氯和氯水的成分不相同
D.新制氯水呈浅黄绿色,放置数天后颜色变浅
参考答案:A.新制氯水中含Cl2、H2O、HClO三种分子及四种离子,故A错误;
B.氯水中HClO具有漂白性,则新制氯水使蓝色石蕊试纸褪色,故B错误;
C.氯水为混合物,液氯为单质,所以液氯和氯水的成分不相同,故C正确;
D.新制氯水中含较多的氯气,为浅黄绿色,氯水中HClO不稳定,见光易分解,则新制氯水呈浅黄绿色,放置数天后颜色变浅,故D正确;
故选CD.
本题解析:
本题难度:简单
3、计算题 (7分)一定量的氢气在氯气中燃烧,所得混合物用100mL 4.00mol/L的NaOH溶液(密度为1.20g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0. 0800mol。(以下计算要有计算过程)
(1)求原NaOH溶液的质量分数为多少?
(2)求所得溶液中Cl-的物质的量。
(3)所用氯气和参加反应的氢气的物质的量之比为多少?
参考答案:解:(1)(2分)n(NaOH)=0.1L×4.00mol/L=0.4mol
w(NaOH)=0.4mol×40g/mol÷(100ml×1.20g/mL) ×100%≈13.3%
(2) (2分)由钠守恒可知,溶液中
n(NaOH)=n(NaCl) +n(NaClO)
n(Cl-)=0.4mol-0.0800mol=0.32mol
(3)(3分) Cl2+H2="2HCl?" Cl2+2NaOH=" NaCl+" NaClO+H2O
由反应方程式可知:与NaOH反应的氯气为0.08mol,该反应生成的NaCl为0.08mol,因此氢气燃烧产生氯化氢为0.24mol,则氢气为0.12mol.总的氯气为0.20mol。所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=5︰3
本题解析:略
本题难度:一般
4、选择题 下列关于氯气的说法错误的是( )
A.密度比空气大
B.有毒
C.黄绿色气体
D.使干燥的有色布条褪色
参考答案:A.氯气的式量为71,空气的平均式量为29,所以氯气的密度大,故A正确;
B.氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成有害的影响,故B正确;
C.氯气是一种黄绿色、有刺激性气味的气体,在低温和加压条件下能转变为液态和固态,故C正确;
D.潮湿的氯气具有漂白性,干燥的氯气不具备漂白性,真正起漂白作用的是次氯酸,潮湿的氯气具有漂白性的原因是:氯气与水反应生成具有漂白性的次氯酸,所以氯气不能使干燥的有色布条褪色,故D错误;
故选D.
本题解析:
本题难度:一般
5、选择题 关于酸、碱、盐的定义,下列各种说法中正确的是
A.化合物电离出的阳离子有氢离子的就是酸
B.化合物电离出的阴离子有氢氧根离子的就是碱
C.盐电离出的阳离子不一定都是金属阳离子
D.NH4Cl电离的电离方程式是NH4Cl====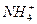 +Cl-,NH4Cl属于盐
+Cl-,NH4Cl属于盐
参考答案:CD
本题解析:酸的定义为电离时生成的阳离子全部是氢离子的化合物。碱的定义为电离时生成的阴离子全部是氢氧根离子的化合物。要注意A、B没有“全部”二字,都是不正确的。盐电离时生成的阳离子一般为金属离子,也可以是铵根离子(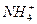 ),这样的盐称为铵盐。
),这样的盐称为铵盐。
本题难度:简单