微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成?。
(2)氯气能使湿润的红色布条退色。对于使湿润的红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
提出问题
| 收集资料
| 提出假设
| 验证假设
| 得结论出
|
氯水中何种物质能使湿润的红色布条退色?
| ①氯气有强氧化性
②氯气与冷水反应生成盐酸和次氯酸
③次氯酸有强氧化性
| ①?
②?
③?
④H2O使布条退色
| ①:实验①:把红色干布条放入充满氯气的集气瓶中,布条不退色
实实验②:?;
实验③:把红色布条放在水里,布条不退色
| ?
|
?
参考答案:(1)将盛满氯水的无色矿泉水瓶倒置在水槽中,光照一段时间后,瓶底有无色气体生成。将瓶子倒转过来,把带火星的木条放在瓶口,若木条复燃,证明HClO分解生成的气体为氧气
(2)提出假设:①氯气使红色布条退色
②HClO使红色布条退色
③盐酸使红色布条退色
验证假设:②把红色布条伸入稀盐酸中,红色布条不退色
结论:次氯酸使红色布条退色
本题解析:(2)提出假设是根据收集到的资料结合所学知识进行的。氯气有氧化性,那么假设氯气使红色布条退色,氯气和水生成盐酸和次氯酸,假设盐酸或次氯酸能使红色布条退色,实验②把红色布条放到稀盐酸中,红色布条不退色。氯水中的氯气、稀盐酸、水均不能使红色布条退色,说明是HClO使红色布条退色。
本题难度:一般
2、填空题 氯是重要的非金属元素。
30.NaCl和浓硫酸微热制取氯化氢的化学方程式为?;
可用?试纸放在瓶口以检验氯化氢气体是否集满。
31.新制氯水中含有的分子有:Cl2、H2O和?;光照新制氯水的化学方程式为?;工业是用电解食盐水制取氯气,阴极的电极反应式为:
2H++2e→H2↑,则阳极的电极反应式为?。
32.已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是______(选填编号)。
a. NaCl? Na2SO4? b.? NaCl? NaBr? Na2SO4
c. NaCl? Na2SO4? I2? d.? NaCl? NaI? Na2SO4
参考答案:30.NaCl+ H2SO4 (浓)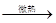 NaHSO4+HCl↑(2分);湿的蓝色石蕊试纸(或湿的pH试纸)(1分)。
NaHSO4+HCl↑(2分);湿的蓝色石蕊试纸(或湿的pH试纸)(1分)。
31.HClO(1分);? 2 HClO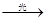 ?2HCl+O2↑(1分); 2Cl--2e→Cl2↑(1分)
?2HCl+O2↑(1分); 2Cl--2e→Cl2↑(1分)
32.ab(2分)
本题解析:30.NaCl和浓硫酸微热制取氯化氢时生成NaHSO4;氯化氢气体为酸性气体,可用湿润的紫色石蕊试纸等放在瓶口以检验氯化氢气体是否集满。
31.新制氯水中含有的分子有:Cl2、H2O和HClO;光照新制氯水,氯水中的HClO分解为HCl和O2;工业是用电解食盐水制取氯气,阴极是阳离子H+放电生成H2,2H++2e→H2↑,阳极是阴离子Cl-放电生成Cl2。
32.已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是
极少Cl2:只有Na2SO3部分反应,产物NaCl、NaBr、NaI、Na2SO4(由Na2SO3在空气中氧化),b正确。;
适量Cl2:有NaI、Na2SO3反应,产物NaCl、NaBr、Na2SO4;
过量Cl2:NaBr、NaI、Na2SO3全分反应,产物NaCl、Na2SO4,a正确 。
本题难度:一般
3、计算题 将2.80 g CaO与500 mL某浓度的盐酸充分反应,将所得溶液平均分成两份。向其中一份中加入足量的AgNO3溶液,生成的沉淀干燥后的质量为14.4 g;向另一份溶液中加入足量Zn粒,产生0.560 L(标准状况)气体。计算所用盐酸中HCl的物质的量浓度。
参考答案:0.400 mol·L-1
本题解析:CaO+2HCl====CaCl2+H2O
Zn+2HCl====ZnCl2+H2↑
由于Zn跟HCl反应放出H2,知CaO与盐酸反应中盐酸过量,CaO全部与HCl反应生成CaCl2,即所得溶液是CaCl2和HCl的混合液。
法一:守恒法
Ag++Cl-====AgCl↓
Cl-全部来自于盐酸中
c(HCl)=n(Cl-)=n(AgCl)×2=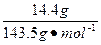 ×2≈0.200 mol
×2≈0.200 mol
c(HCl)=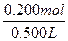 ="0.400" mol·L-1。
="0.400" mol·L-1。
法二:关系式(量)法
跟CaO反应的盐酸
n1(HCl)=2n(CaO)=2×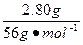 ="0.100" mol
="0.100" mol
跟Zn反应的盐酸
n2(HCl)=2×2n(H2)=2×2×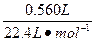 ="0.100" mol
="0.100" mol
总盐酸量n(HCl)="0.200" mol
c(HCl)=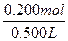 ="0.400" mol·L-1。
="0.400" mol·L-1。
本题难度:简单
4、选择题 下列物质能通过化合反应直接制得的是( )
①FeCl2?②H2SO4?③NH4Cl?④NO.
A.只有①②③
B.只有②③④
C.只有①③④
D.全部
参考答案:①因铁在氯气中燃烧生产氯化铁,发生化合反应,故①正确;
②因三氧化硫与水化合生成硫酸,发生化合反应,故②正确;
③因氨气和氯化氢反应生成氯化铵,发生化合反应,故③正确;
④因氮气和氧气在放电条件下生成一氧化氮,发生化合反应,故④正确,
故选D.
本题解析:
本题难度:一般
5、简答题 实验一、定性探究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因______.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______.
第二份:______.
(3)试根据所学知识推测,在②的滤液中含?有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)______.
实验二、定量探究:
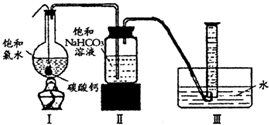
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为______.
A.饱和碳酸钠溶液?B.饱和碳酸氢钠溶液?C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
明显小于.若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.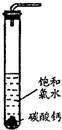
参考答案:(1)在饱和氯水中存在如下平衡:Cl2+H2O

?HClO+HCl,盐酸的酸性比碳酸强,而HClO的酸性比碳酸弱,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO,
故答案为:在饱和氯水中存在如下平衡:Cl2+H2O

?HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO;
(2)加入过量的块状碳酸钙,过量的CaCO3与溶液中的HCl发生反应,最终生成HClO,同时生成Ca(HCO3)2和CaCl2,
所以与石灰水混合,立即产生大量白色沉淀,反应的离子方程式为Ca2++HCO3-+OH-=CaC03↓+H2O,溶液中存在大量的HCO3-离子,加入盐酸,发生HCO3-+H+=CO2↑+H2O,会有大量气体生成,
故答案为:Ca2++HCO3-+OH-=CaC03↓+H2O;HCO3-+H+=CO2↑+H2O;
(3)由实验③可知,除HClO外,还生成Ca(HCO3)2和CaCl2,故答案为:HClO、Ca(HCO3)2、CaCl2;
(4)二氧化碳难溶于饱和碳酸氢钠溶液,可用排饱和碳酸氢钠溶液的方法收集二氧化碳气体,故答案为:B;
(5)碳酸氢钙不稳定,加热生成碳酸钙和二氧化碳,导致生成的二氧化碳的物质的量小于原碳酸钙的物质的量,
故答案为:碳酸钙与氯水反应生成的?Ca(HC03)2?再受热时,除生成?CO2?外,还生成了?CaC03.
本题解析:
本题难度:一般