微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是_________,它是由___________键形成的分子;
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为_____________________。
参考答案:(1)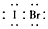 ;共价
;共价
(2)
本题解析:
本题难度:一般
2、填空题 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效。
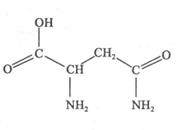
(1)天冬酰胺所含元素中,??(填元素名称)元素基态原子核外未成对电子数最多,天冬酰胺中碳原子的杂化轨道类型有?种。
(2)H2S和H2Se的参数对比见表。
化学式
| 键长/nm
| 键角
| 沸点/℃
|
H2S
| 1.34
| 92.3o
| 一60.75
|
H2Se
| 1.47
| 91.0o
| 一41.50
|
?
①H2Se的晶体类型为?,含有的共价键类型为?。
②H2S的键角大于H2Se的原因可能为?。
(3)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
编号
| I5/kJ·mol-1
| I6/kJ·mol-1
| I7/kJ·mol-1
| I8/kJ·mol-1
|
A
| 6990
| 9220
| 11500
| 18770
|
B
| 6702
| 8745
| 15455
| 17820
|
C
| 5257
| 6641
| 12125
| 13860
|
?
A是??(填元素符号),B的价电子排布式为 ?。
参考答案:(1)氮(1分)? 2 (1分)
(2)①分子晶体(2分) 极性键(2分)
② 由于S的电负性强于Se,形成的共用电子对斥力大,键角大(2分)
(3)Mn(2分) 3d54s1(2分)
本题解析:(1)天冬酰胺含有碳、氢、氧、氮四种元素,基态原子核外未成对电子数最多的为氮元素。
(2)①H2Se在常温时为由非金属元素形成的气态氢化物,为分子晶体;H与Se为不同元素,形成的共价键为极性键。
②S与Se为同主族元素,S位于第三周期、Se位于第四周期,S的电负性强于Se,形成的共用电子对斥力大,所以H2S的键角大于H2Se。
(3)A原子 I5、I6、 I7、 I8相差不大,所以A原子失去的8个电子都是价电子,所以A为Mn元素;B、C原子I7比I6大了很多,说明B、C原子的价电子为6,而各级电离能B大于C,说明B为第四周期的Cr,C为钼(Mo)位于第五周期,Cr的价电子排布式为:3d54s1
本题难度:一般
3、填空题 某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为?。(用元素符号表示)
(2)D元素原子的最外层电子排布图为?。
(3)该配位化合物的化学式为?,配体的中心原子的杂化方式为?。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为?。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为?,分子中含有?个s键,?个p键。
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的 化学式为?。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式?。
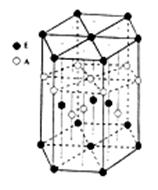
参考答案:(1)N>O>S (2分)?(2) (1分)
(1分)
(3)Cu(NH3)4SO4×H2O (1分)? sp3杂化(1分)?(4)H2O与H2O2之间形成氢键(2分)
(5)H-N=N-H (2分)? 3(1分)? 1(1分)?
(6)CuH(2分)? 2CuH+3Cl2 2CuCl2+2HCl(2分)
2CuCl2+2HCl(2分)
本题解析:原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,判断D是S、C是O;E元素的外围电子排布为(n-1)dn+6nsl,n-1≥3,0<n+6≤10,n=4,故E是Cu。A在比例中相对很多,可能是H元素;将H、O、S、Cu(蓝色)的化合价+1、-2、+6、+2带入比例组成的H14B4O5SCu中,B为-3价,在O元素之前,是N元素。
本题难度:一般
4、选择题 H2O与H2S结构相似,都是V形的极性分子,但是H2O的沸点是100 ℃,H2S的沸点是-60.7 ℃,引起这种差异的主要原因是(?)。
A.范德华力
B.共价键
C.氢键
D.相对分子质量
参考答案:C
本题解析:氧原子的电负性较大,水中的氧原子与氢原子可形成氢键,氢键使水的沸点反常的高,但硫的电负性相对较小,所以不会形成氢键,其沸点较低。
本题难度:一般
5、选择题 观察下列模型并结合有关信息,判断有关说法正确的是( )
| B12结构单元 | SF6分子 | S8 | HCN
结构模型示意图




备注
熔点1873K
/
易溶于CS2
/
|
A.单质硼属原子晶体.结构单元中含有30个B-B键.含20个正三角形
B.SF6是由极性键构成的极性分子
C.固态硫S属于原子晶体
D.HCN的结构式为H:C::N
参考答案:A.由图知,每个B原子具有12×5个共价键,12个B原子共含有12×12×5=30个共价键,含有的三角形数目=30÷(12×3)=20,故A正确;
B.SF6空间构型为对称结构分子极性抵消,正负电荷的重心重合,电荷分布均匀,SF6为非极性分子,故B错误;
C.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,故C错误;
D.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,碳原子半径大于氮原子半径,氮原子半径大于氢原子半径,所以该比例模型中最左端的是氢原子,中间的是碳原子,最右边的是氮原子,其结构式为H-C≡N,故D错误.
故选A.
本题解析:
本题难度:简单