微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是(?)
A.当7.8 g Na2O2与H2O完全反应时,有0.2 mol电子发生了转移
B.FeCl2溶液与K3[Fe(CN)6]溶液混合后得到特征蓝色沉淀,利用此反应可检验Fe2+
C.用浓盐酸酸化KMnO4溶液以增强其氧化性
D.在3NO2+H2O=2HNO3+NO中,氧化剂和还原剂的质量比为2:1
参考答案:B
本题解析:Na2O2与H2O反应中,Na2O2即是氧化剂,又是还原剂,2molNa2O2发生反应转移电子2mol,A错误;Fe2+与[Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2蓝色沉淀,B正确;KMnO4氧化性强于Cl2,高锰酸钾溶液能与盐酸反应(2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O),高锰酸钾溶液不能用盐酸酸化,一般用硫酸酸化,C错误;3NO2+H2O=2HNO3+NO反应中,氧化剂和还原剂都是NO2,氧化剂和还原剂物质的量比为1:2,D错误。
点评:检验Fe2+的反应源自课本【实验探究】栏目,对这类栏目不可忽视。
本题难度:一般
2、选择题 下列反应中,属于氧化还原反应的是
[? ]
A.2H2O2 2H2O + O2↑
2H2O + O2↑
B.2Al(OH)3 Al2O3 + 3H2O
Al2O3 + 3H2O
C.FeO + 2HCl = FeCl2 + H2O
D.CuCl2 + 2NaOH = Cu(OH)2↓+ 2NaCl
参考答案:A
本题解析:
试题分析:
选项A,2H2O2=2H2O + O2↑,有化合价变化,是氧化还原反应;
选项B,2Al(OH)3=Al2O3?+ 3H2O,反应前后化合价不变,不是氧化还原反应;
选项C,FeO + 2HCl = FeCl2?+ H2O,反应前后化合价不变,不是氧化还原反应;
选项D,CuCl2?+ 2NaOH = Cu(OH)2↓+ 2NaCl,反应前后化合价不变,不是氧化还原反应。
故选:A
本题难度:简单
3、选择题 可以用浓磷酸代替浓硫酸制取溴化氢气体的理由是(?)
A.浓磷酸与浓硫酸的性质相似
B.浓磷酸与浓硫酸一样难挥发,且属非氧化性酸
C.浓磷酸无氧化性,只有还原性
D.浓磷酸的酸性强于氢溴酸
参考答案:B
本题解析:制取溴化氢是利用非氧化性的高沸点酸可与挥发性酸的盐反应这一原理。浓磷酸属于非氧化性酸是指其中的磷元素难体现氧化性,但并不等于其无氧化性,其中的氢元素是具有氧化性的。磷酸是弱酸中较强的酸,一般称为中强酸,酸性比氢溴酸弱。所以应选B。
本题难度:简单
4、实验题 (16分)(1)(6分)测定Na2O和Na的混合物中金属钠的质量分数可用下图所示的几套仪器组合:
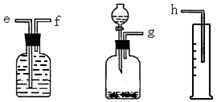
①用接口字母标出各仪器连接的顺序?量筒在实验中的作用是?
②有一块表面氧化成Na2O的金属钠,其质量为2.0g,实验后在量筒中收集到0.224L水,求样品中金属钠的质量分数是?。(假设在标准状况下测定)
(2)(10分) HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
①人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填序号)。
A.亚硝酸盐被还原? B.维生素C具有还原性
C.维生素C将Fe3+还原为Fe2+?D.在上述变化中亚硝酸盐是还原剂
②下列方法中,不能用来区分NaNO2和NaCl两种溶液的是________(填序号)。
A.测定这两种溶液的pH?
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别?
D.用AgNO3和HNO3两种试剂来区别
③某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___________________________________。
④ Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是________(填序号)。
a.Cl2 ? b.Fe ? c.H2O2 ? d.HNO3
⑤配平下列方程式:
参考答案:(1)①? g- f-e-h ;测量气体的体积②? 23.0% (2)①? D?②? B
③ NO2- + Cl2 + H2O ="=" NO3- +2H+ +2Cl- ?④ C?⑤? 2、16、3、2、6、6、8
本题解析:(1)①钠溶于水生成氢气,因此可通过测量氢气的体积来计算钠的物质的量,所以正确的顺序是g- f-e-h。因此量筒的作用是测量气体的体积。
②在量筒中收集到0.224L水,则生成氢气是0.01mol,因此钠的物质的量是0.02mol,质量是0.46g,所以钠的质量分数是0.46÷2.0=0.23,即质量分数是23%。
(2)服用维生素C可解毒,这说明维生素C能把铁离子还原生成亚铁离子,所以维生素C具有还原性,选项ABC都是正确的,选项D不正确,答案选D。
(3)亚硝酸钠溶于水水解显碱性,而氯化钠溶于水显中性,选项A正确;甲基橙的变色范围是3.1~4.4,所以两种溶液都显黄色,选项B不正确;亚硝酸钠具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,选项C正确;亚硝酸银不能溶于水,但能溶液硝酸中,而氯化银不能溶液硝酸中,所以选项D正确,答案选B。
(4)观察到氯水褪色,说明氯水beu还原,所以方程式是NO2- + Cl2 + H2O ="=" NO3- +2H+ +2Cl-。
(5)ad都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确额的答案选C。
(6)根据方程式可知,铁元素的化合价从+3价升高到+6价,失去3个电子;氯元素的化合价从0价降低到-1价,得到1个电子,所以根据电子的得失守恒和质量守恒定律可知,配平后的化学计量数依次是2、16、3、2、6、6、8。
本题难度:一般
5、选择题 反应①、②分别是从海藻灰和智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4 +2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
A.两个反应最终都能使溶液的酸性增强
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO42—>IO3—>I2
D.反应①、2中生成等量I2时转移电子数之比为1:5
参考答案:D
本题解析:本题考查氧化还原反应.
反应①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4 +2H2O+I2中,反应物中有H2SO4这种强酸,而生成物中NaHSO4是种酸式盐,因而反应后酸性是降低的,故A错
反应①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4 +2H2O+I2中,NaI中的 变成的
变成的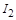 ,其化合价升高,碘元素被氧化,因而B错;
,其化合价升高,碘元素被氧化,因而B错;
在反应①中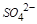 在反应前后各元素的化合价均无变化,因而没有体现其氧化还原的特性,因而C错误;
在反应前后各元素的化合价均无变化,因而没有体现其氧化还原的特性,因而C错误;
反应①中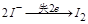 ,生成
,生成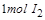 需转移电子数为
需转移电子数为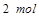 ;反应②中,
;反应②中,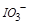 的碘的化合价为
的碘的化合价为 ,所以
,所以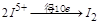 ,生成
,生成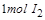 需转移电子数为
需转移电子数为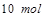 ;故生成等量的时转移电子数之比为
;故生成等量的时转移电子数之比为 .
.
故正确答案为D
本题难度:简单