微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列褪色过程不是因为氧化还原反应而褪色的是(?)
A.SO2气体通入到溴水中使溴水褪色
B.氯水使滴有酚酞的NaOH溶液褪色,再加入NaOH后不变红
C.SO2气体能使品红溶液褪色
D.在含有碘单质的淀粉溶液中,加入KOH溶液后蓝色褪去
参考答案:C
本题解析:A. SO2+Br2+H2O=H2SO4+2HBr,正确;B.使滴有酚酞的NaOH溶液褪色,是氯水有强氧化性,正确;D. I2+2NaOH=NaI+NaIO+H2O, 碘单质发生氧化还原反应,而使蓝色褪去。C.SO2气体能使品红溶液褪色,体现的是SO2的漂白性,SO2与有色物质化合生成不稳定的无色物质。不是因为氧化还原反应而褪色。
本题难度:简单
2、填空题 (7分).已知:CuI是难溶于水的白色固体。氧化性Cu2+>I2> Cu+,还原性Cu>I-> Cu+
(1)根据物质氧化性还原性的强弱推测,在溶液中Cu2+和I-反应的产物是?、?;
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为_______________________;
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性H2S_______(填“>”、“<”、“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度________(填“高”、“低”、“相等”);
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg=Cu2HgI4(亮黄色)+2Cu。下列关于该化学方程式的说法错误的是_____________。
a.?该反应被氧化的元素是铜元素和汞元素
b.该反应的氧化剂为CuI
c.Cu2HgI4既是氧化产物又是还原产物?
参考答案:(7分)(1)CuI、I2(2分)?(2)2Cu+I2 =2CuI↓(2分)
(3)>,高(2分)?(4)a c(1分)(漏选、错选、多选不得分)
本题解析:(1)氧化性Cu2+>I2> Cu+,还原性Cu>I-> Cu+,所以在溶液中Cu2+和I-反应的产物应该是CuI、I2。
(2)久置于空气中的HI溶液呈黄色,说明有单质碘生成,所以加入铜后的反应方程式是2Cu+I2 =2CuI↓。
(3)硫化氢的还原性大于碘离子的,所以也可以通过硫化氢还原碘单质。由于在该反应中碘单质全部被还原生成碘化氢,所以浓度高。
(4)根据反应的方程式可知,Hg的化合价升高,做还原剂。铜元素的化合价从+1价降低到0价,所以CuI是氧化剂,Cu2HgI4是氧化产物,而铜是还原产物,所以选项ac不正确,答案选ac。
点评:在判断氧化还原时,关键是准确标出有关元素的化合价,找出发生变化的元素,然后根据概念进行判断即可。
本题难度:一般
3、填空题 一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+?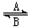 ?Fe3+。在过程A中,Fe2+作?剂。
?Fe3+。在过程A中,Fe2+作?剂。
(2)维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有?性。
(3)某同学要检验Fe3+,向溶液中加入 ?(写化学式)溶液变成红色。要除去FeCl3溶液中少量的氯化亚铁,可行的办法是??(填字母)。
a.加入铜粉? b.加入铁粉? c.通入氯气? d.加入NaOH溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式??。
(4)电子工业常用30%的FeCl3 溶液腐蚀铜箔,制造印刷线路板,写出FeCl3 与金属铜反应的离子方程式 ?。
(5)使用过的腐蚀液会失效,但可以回收利用,某兴趣小组为了从使用过的腐蚀液中回收铜,应使用的试剂是??(填字母)
a.铜粉? b.氯气? c.铁粉? d.KSCN溶液
参考答案:(8分)(1)还原(1分);?(2)还原(1分);
(3)KSCN (1分)? c (1分)
2Fe2++Cl2==2Fe3++2Cl?(1分)
(4)2Fe3++Cu2+==2Fe2++Cu2+(1分)
(5)c (2分)
本题解析:(1)在A中铁元素的化合价由+2价升高到+3价,铁元素的化合价升高,则A中Fe2+做还原剂。
(2)由信息维生素C可使食物中的三价铁离子还原成二价铁离子,该反应中铁元素的化合价降低,则维生素C中某元素的化合价升高,即维生素C为还原剂,体现还原性。
(3)Fe3+和KSCN溶液发生特征反应,反应后溶液呈红色。氯化亚铁被强化剂氧化呈氯化铁,故选c。离子方程式为2Fe2++Cl2==2Fe3++2Cl?。
(4)FeCl3 与金属铜发生氧化还原反应,铜溶解,反应的离子方程式为2Fe3++Cu2+==2Fe2++Cu2+。
(5)铁的活泼性大于铜的活泼性,置换出铜一般用铁,故选c。
点评:本题属于信息习题,考查氧化还原反应中氧化剂、还原剂及氧化性、还原性,明确元素的化合价变化来分析是解答本题的关键,难度中等。
本题难度:一般
4、选择题 高铁酸钾(K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
参考答案:A
本题解析:高铁酸钾中铁元素的化合价为+6价,处于较高价态,因此具有强氧化性,具有杀菌消毒作用,而高铁酸根离子水解产生的胶体又具有吸附水中杂质的作用。因此答案选A。
点评:本题考查了氧化性还原性与化合价的关系,只要掌握“高价态元素具有强氧化性,低价态元素具有强还原性”即可解答此题。
本题难度:简单
5、填空题 多硫化钠(Na2SX)在制革工业中常用作皮毛的脱毛剂,农业上可作杀虫剂,也是分析化学中的常用试剂。在碱性溶液中,Na2SX与NaBrO3发生反应生成Na2SO4与NaBr。
(1)、上述反应中发生氧化反应的物质是?,被还原的元素是?(填写元素符号或化学式)。
(2)、若Na2SX与NaBrO3反应的物质的量之比为3:10,则x = ?。
(3)、NaBrO3也可以在酸性条件下与NaBr反应生成Br2。若生成6mol Br2,则反应中转移电子的物质的量为?。
(4)、根据上述两个反应,可推知Na2SX、 Br2、NaBr还原性由强到弱的顺序是?(填写化学式)。
参考答案:Na2SX,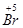 ?(1分1答,共2分)
?(1分1答,共2分)
3 (2分)
10 mol (2分)
Na2SX > NaBr > Br2(2分)
本题解析:(1)反应Na2SX+NaBrO3→Na2SO4+NaBr中,溴的化合价由+5价降至—1价,被还原,而硫元素的化合价由负价升到+6价,被氧化
(2)Na2SX中x个硫原子的化合价共—2价,最终均升为+6价,共升高6x+2价,而NaBrO3中溴的化合价由+5价降至—1价,共降低6价,为升降守恒,两者的物质的量比为3:3x+1,当Na2SX与NaBrO3反应的物质的量之比为3:10,可得x=3
(3)溴元素发生了归中反应:BrO3-+5Br-+6H+=3Br2+3H2O,反应中有5个电子的转移,当有6mol Br2,则反应中转移电子的物质的量为10mol
(4)根据还原剂的还原性强于还原产物的还原性可得Na2SX、 Br2、NaBr还原性由强到弱的顺序是Na2SX > NaBr > Br2
本题难度:简单