微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 图中曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是
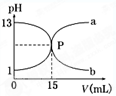
A.盐酸的物质的量浓度为1 mol/L
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
参考答案:B
本题解析:试题分析:盐酸与氢氧化钠的相互滴定,所以酚酞可以做指示剂使用;由图像可以看到:未开始滴定时,PH=1? PH=13可得盐酸和氢氧化钠的物质的量浓度是0.1mol/L。曲线b是盐酸滴定氢氧化钠的滴定曲线
;曲线a是氢氧化钠滴定盐酸的滴定曲线.故选B。
考点:化学图像 滴定操作
点评:酸碱滴定特别注意:强酸滴定弱碱时用甲基橙做指示剂;强碱滴定弱酸时用酚酞。其他情况可用紫色石蕊试剂。
本题难度:困难
2、选择题 下列物质中,导电性最差的是
A.固态氯化钠
B.熔融的氯化钠
C.铜
D.石墨
参考答案:A
本题解析:物质能导电的条件是有自由移动的离子或自由电子,熔融的氯化钠、铜、石墨均是电的良导体;固体氯化钠中阴、阳离子不能自由移动,只能在一定范围内振动,不能导电.
本题难度:简单
3、选择题 下列物质属于非电解质的是( )
A.Cl2
B.CH3COOH
C.C2H5OH
D.Al2(SO4)3
参考答案:A、氯气为单质,既不是电解质,也不是非电解质,故A错误;
B、乙酸在溶液中能够电离出醋酸根离子和氢离子,其溶液导电,乙酸属于电解质,故B错误;
C、乙醇不导电,其水溶液也不导电,所以乙醇为非电解质,故C正确;
D、硫酸铝在溶液中和熔融状态下都能够导电,硫酸铝为电解质,故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.二氧化硫具有较强的还原性,故不能用浓硫酸干燥
B.含极性键的共价化合物一定是电解质
C.氯化钠、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质
D.天然气、酒精和液化石油气分别属于化石能源、不可再生能源和二次能源
参考答案:A.二氧化硫和浓硫酸中硫元素物中间价态,不能发生氧化还原反应,二氧化硫能用浓硫酸干燥,故A错误;
B.含极性键的共价化合物一定不一定是电解质,例如二氧化碳、氨气等都含极性键,但是本身都不能电离,故B错误;
C.氯化钠在水溶液中完全电离属于强电解质;冰醋酸在水溶液中部分电离属于弱电解质;酒精是化合物其水溶液和熔融状态都不导电,属于非电解质,故C正确;
D.液化石油气是直接利用的自然资源,属于一次能源,故D错误;
故选C.
本题解析:
本题难度:一般
5、选择题 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.0.1 mol·L-1HA的溶液中由水电离出的 c(H+)=1×10-13 mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
参考答案:B
本题解析:试题分析:室温下,将等体积等浓度的HA和KOH混合(忽略体积变化),溶液呈碱性,说明该酸是弱酸,A.溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),该盐是强碱弱酸盐,其溶液呈碱性,c(OH-)>c(H+),水的电离较微弱,所以c(A-)>c(OH-),A正确;B.HA是弱酸,0.1 mol·L-1HA的溶液中H+ 浓度小于0.1 mol·L-1,由水电离出的 c(H+)大于1×10-13 mol/L,B错误;C.当等物质的量的酸和碱恰好反应时,溶液呈碱性,要使等体积的酸和碱混合后溶液呈中性,则酸的浓度应大于碱,根据物料守恒得c(A-)+c(HA)>0.1 mol·L-1,故C正确;D.溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),溶液呈中性,即c(OH-)=c(H+),则c(K+)=c(A-),中性溶液中水的电离较微弱,所以c(A-)>c(OH-),故D正确;故选B.
考点:酸碱混合时的定性判断及有关ph的计算;离子浓度大小的比较
本题难度:一般