微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为?mol/L.
(1)若从中取出50mL,其物质的量浓度为?mol/L;含溶质质量?g.
(2)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为?mol/L,SO42-的物质的量浓度为?mol/L.
参考答案:
本题解析:
本题难度:一般
2、选择题 将5 mol· L-1 HCl溶液和1mol·L-1 HCl溶液混合,配制2mol· L-1HCl溶液,请问需要5 mol·L-1 HCl溶液和1mol·L-1 HCl溶液的体积之比是:(设混合后溶液的体积等于混合前两种溶液体积之和)?(  ?)
?)
A.1:3
B.3 :1
C.1:4
D.4:1
参考答案:A
本题解析:略
本题难度:一般
3、计算题 (本题共14分)氨在工业生产中有广泛的用途。
54.某工厂平均每天产生约600 m3废氨水(该氨水浓度为153 mg/L,密度为1 g/cm3),该废氨水中氨的物质的量浓度为_____________。
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,析出晶体后过滤,得到滤液31.2g,则NH4HCO3的产率为_______%。(保留1位小数)
56.NH3常用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
57.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时得到副产品氮肥。已知吸收尾气后的氨水全部转化为铵盐。取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀。通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比。
参考答案:54.9×10-3 mol·L-1 (3分) ;55.91.8 (3分) ;56.0.14 (3分)
57.(5分)NH4)2SO3、NH4HSO3、(NH4)2SO4。它们的物质的量的比是5 : 4 : 1。
本题解析:54.该废氨水中氨的物质的量浓度C=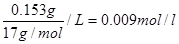 ;
;
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,若NH3中的N元素完全转化为NH4HCO3,则需要CO2的物质的量是0.800mol,理论产量是0.800mol×79g/mol=63.2g,实际产量是0.800mol×44g/mol+54.0 g-31.2g=58g,所以NH4HCO3的产率为(58g÷63.2g)×100%=91.8%;
56.假设NH3的物质的量是1mol,则反应需要氧气的物质的量是1.25mool,由于空气中氧气的体积分数为0.20,则需要空气的物质的量是1.25mool÷0.2=6.25mol.由于气体的体积比等于它们的物质的量的比,所以氨—空气混合物中氨的体积分数为[(1mol÷(1mol+6.25mol))×100%=14%;
57. ①向该铵盐中加入硫酸产生SO2, n(SO2)=0.09mol, 说明在该铵盐中含有(NH4)2SO3、NH4HSO3中至少一种 ;加入足量Ba(OH)2,产生0.16mol NH3,n(NH3)=0.16mol;同时产生沉淀21.86g。若沉淀完全是BaSO3,其质量是0.09mol×217g/mol=19.53g<21.86g, 所以含BaSO3和BaSO4。故原铵盐含有亚硫酸盐和硫酸盐;②n(NH3)=0.16mol
本题难度:困难
4、选择题 6.4g铜与过量的硝酸(8mol/L 60mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+为n mol,NO、NO2混合气体的物质的量为?

A.0.28mol
B.(0.28-n)mol
C.(n+0.2)mol
D.(0.48-n) mol
参考答案:B
本题解析:6.4g铜的物质的量是0.1mol,则生成硝酸铜是0.1mol。溶液中氢离子的物质的量是nmol,所以没有被还原的硝酸的物质的量是0.1mol×2+nmol。因此被还原的硝酸的物质的量是8mol×0.06L-0.2mol-nmol=0.28mol-nmol,则根据原子守恒可知NO、NO2混合气体的物质的量为(0.28-n)mol,答案选B。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和灵活应变能力。该题的关键是明确反应原理,然后借助于各种守恒法进行列式计算即可。
本题难度:一般
5、填空题 0.5molH2O的质量为_______________,其中含有_______________个水分子,__________________个电子。
参考答案:9g;3.01×1023;3.01×1024
本题解析:
本题难度:简单