微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g)+H2O(g)=CO(g) + 3H2(g) △H=+206.0 kJ·mol-1
II:CO(g)+2H2(g)=CH3OH (g) △H=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H= 。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图。假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 mol·L-1·min-1。
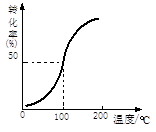
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应II生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是 (填序号):
a.c ( H2 )减少;
b.平衡常数K增大;
c.CH3OH 的物质的量增加;
d.正反应速率加快,逆反应速率减慢;
e.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用下图装置模拟上述过程,
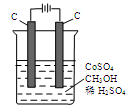
则:
Co2+在阳极的电极反应式为: ;
除去甲醇的离子方程式为 。
参考答案:(1)+77.0 kJ·mol-1 (2)0.03
(3)c e
(4)Co2+-e-= Co3+(或6Co2+-6e-=6Co3+,3分)
6Co3++CH3OH+H2O ==6Co2++CO2↑+6H+
本题解析:(1)由盖斯定律,方程式I 和II的焓变相加,可计算得到CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:CH4(g)+H2O(g)=H2(g) +CH3OH (g) △H =+77.0 kJ·mol-1;由方程式I,结合图像,计算得甲烷表示的化学反应速率为0.01mol·L-1·min-1,进而解得氢气表示的反应速率;(3)改变条件会导致各成分的浓度增大,且压强增大,反应速率增大,平衡正向移动,甲醇的物质的量增加,重新平衡时c ( H2 )/ c (CH3OH )减小。由于温度恒定,所以K值不变;(4)由电解原理,阳极发生氧化反应:Co2+-e-= Co3+(或6Co2+-6e-=6Co3+),由“Co3+将甲醇氧化成CO2和H+”确定除去甲醇的离子方程式:6Co3++CH3OH+H2O ==6Co2++CO2↑+6H+。
考点:盖斯定律、化学反应速率的计算、化学平衡的移动、电极反应式的书写。
本题难度:困难
2、选择题 已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8的含有Fe2(SO4)3杂质的CuSO4溶液中加入适量的黑色粉末X,充分搅拌后过滤,将滤液用下图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体 V mL。下列说法正确的是
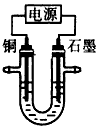
[? ]
A.黑色粉末X是铁粉
B.铜电极连接电源正极
C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
D.铜的相对原子质量的计算式是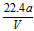
参考答案:C
本题解析:
本题难度:一般
3、填空题 (10分)已知有一种节能的氯碱工业新工艺,将电解池和燃料电池相组合,相关流程如下图所示(电极未标出):回答下列有关问题:

(1)电解池的阴极反应式为 _____________________________________
(2)通入空气的电极为_______________(“正极”或“负极”)
燃料电池中阳离子的移动方向___________(“从左向右”或“从右向左”)。
(3)电解池中产生2 mol Cl2,理论上燃料电池中消耗_____ mol O2。
(4)a、b、c的大小关系为:__________。
参考答案:(10分)(1)2H2O+2e-==H2↑+2OH- (2)正极 从左到右 (3)1 (4)c>a>b
本题解析:(1)电解饱和食盐水的阴极是氢离子放电生成氢气,电极反应式为2H2O+2e-==H2↑+2OH- ;
(2)燃料电池中,燃料发生氧化反应,空气中的氧气发生还原反应,所以通入空气的一极是正极,则右侧是正极,左侧是负极,原电池中电子从负极流向正极,所以电子从从左到右移动;
(3)电解池中产生2omol氯气,转移电子的物质的量是4mol,根据氧气中O元素化合价的变化,可知需要氧气的物质的量是1mol;
(4)阳离子交换膜只允许阳离子通过,所以在氢氧燃料电池中,氢气失去电子生成氢离子与溶液中的氢氧根离子结合为水,使负极的氢氧化钠的浓度降低,氧气得电子与水结合生成氢氧根离子,氢氧根离子不能通过阳离子交换膜而留在正极,而负极中的钠离子移向正极,导致正极出来的氢氧化钠的浓度最大,而负极出来的氢氧化钠的浓度最小,所以a、b、c的大小关系为c>a>b。
考点:考查电化学反应原理的应用,离子的移动方向的判断
本题难度:一般
4、选择题 以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
A.电能全部转化为化学能
B.粗铜接电源正极,发生还原反应
C.溶液中Cu2+向阳极移动
D.利用阳极泥可回收Ag、Pt、Au等金属
参考答案:D
本题解析:粗铜的电解精炼,粗铜接电源正极,发生氧化反应,B错误;溶液中Cu2+向阴极移动,发生还原反应,C错误;电解精炼的过程中电能不能全部转化为化学能,小部分转化为热能。A错误。
本题难度:一般
5、填空题 (14分)煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。
(1)已知:

①C(s) + H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
②CO2(g) + H2(g) ===" CO(g)" + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为 。
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)  N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min)
浓度(mol·L-1)
| 0
| 10
| 20
| 30
| 40
| 50
|
NO
| 1.00
| 0.68
| 0.50
| 0.50
| 0.60
| 0.60
|
N2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
CO2
| 0
| 0.16
| 0.25
| 0.25
| 0.30
| 0.30
|
①10~20min内,N2的平均反应速率v(N2)= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为 。
(4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①乙中A极产生的气体在标准状况下的体积为________________。
②丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是________(填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
参考答案:(1)C(s) + 2H2O(g) = CO2(g) + 2H2(g)
本题解析:
本题难度:困难