微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 定温度、压强和有铁触媒的条件下,在密闭容器中充入N2、H2和NH3 。若起始时n(N2)="x" mol、n(H2)="y" mol、n(NH3)="z" mol (x、y、z均不为0 ),平衡时,n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是(?)
A.x : y ="1" : 3
B.N2、H2的转化率不相等
C.平衡时,H2与NH3的生成速率之比为3 : 2
D.x的取值范围为0<x<0.14
参考答案:B
本题解析:
A、依据B选项分析可知,反应物的起始量之比为1:3,即x:y=1:3,故A正确;
B、题干中平衡时氮气和氢气物质的量之比为1:3,转化量是依据化学方程式计量数的计算剩余转化量氮气和氢气物质的量之比等于1:3,根据平衡起始量-变化量=平衡量,可知,氮气和氢气转化率相同,故B错误;
C、反应过程中和平衡状态下化学反应中物质反应速率之比等于化学方程式的计量数之比,平衡时,H2与NH3的生成速率之比为3:2,故C正确;
D、依据极值转化始转平,平转始,得到氮气的物质的量取值范围,假设反应正向进行
N2+3H2 2NH3
2NH3
起始量(mol)? x? y? z
变化量(mol) x-0.1? y-0.3? 0.08-z
平衡量(mol)? 0.1? 0.3? 0.08
若正向进行彻底,氮气物质的量全部转化,物质的量为0;若反应逆向进行彻底,氮气物质的量为0.14mol,氨气为0,但反应是可逆反应不可能进行彻底,得到氮气的物质的量为
0<n(N2)<0.14mol,故D正确;
故选B.
本题难度:一般
2、填空题 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)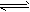 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a=__________
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。则平衡时NH3的物质的量为_____________。
(3)原混合气体与平衡混合气体的总物质的量之比为____________。
(4)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)等于_________________
参考答案:(1)a=16
(2)n (NH3)=8mol
(3)5∶4
(4)3∶3∶2
本题解析:
本题难度:一般
3、选择题 一定条件下反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是
A.2υ(正、A2)=? υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
参考答案:A
本题解析:略
本题难度:一般
4、填空题 已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
| 700
| 800
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
|
回答下列问题:
(1)该反应的平衡常数表达式K=??,△H ?0(填“>”“<”或“=”);
(2)830℃时,向一个5L密闭容器中充入0.20 mol A和0.80 mol B,如反应初始6s内A的平均反应速率v(A)=0.003mol·L-1·s-1,则6s时c(A)=? mol·L-1,C的物质的量为??mol;若反应经一段时间后,达到平衡时A的转化率为
??,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ??;
(3)判断该反应是否达到平衡的依据为?(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 ??
A(g)+B(g)的平衡常数的值为 ??
参考答案:(1)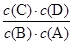 ?<
?<
(2)0.022; 0.09; 80%;80%(3)c(4)2.5
本题解析:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常数表达式k=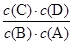 由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0,
(2)反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则6s内△c(A)=0.003mol?L-1?s-1×6s=0.018mol/L,A的起始浓度为0.2mol/5L=0.04mol/L,故6s时时c(A)=0.04mol/L-0.018mol/L=0.022mol/L,
故6s内△n(A)=0.018mol/L×5L=0.09mol,由方程式可知n(C)=△n(A)=0.09mol,
设平衡时A的浓度变化量为x,则:
A(g)+B(g)?C(g)+D(g)
开始(mol/L):0.04?0.16?0?0
变化(mol/L):x?x? x?x
平衡(mol/L):0.04-x? 0.16-x?x?x
故x2/(0.04-x)( 0.16-x)=1,解得x=0.032
所以平衡时A的转化率为0.032/0.04×100%=80%
体积不变,充入1mol氩气,反应混合物各组分的浓度不变,变化不移动,A的转化率不变为80%,
(3)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误,?b.混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,故b错误,c.可逆反应到达平衡时,各组分的浓度不发生变化,故c(A)不随时间改变,说明到达平衡,故c正确,d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成C、D的物质的量,不能说明到达平衡,故d错误,故答案为:c;
(4)同一反应在相同温度下,正、逆反应方向的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为1/0.4=2.5,
本题难度:一般
5、选择题 乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )
CH3COOH+C2H5OH已知该反应的速率随c(H+)的增大而加快。图为CH3COOC2H5的水解速率随时间的变化图。下列说法中正确的是( )

A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t0时反应达到平衡状态
D.tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
参考答案:A
本题解析:刚刚反应开始的时候,乙酸乙酯水解产生醋酸,电离出的氢离子不断增加,反应速率不断加快。随着反应的进行,乙酸乙酯作为反应物,浓度不断减少,此时反应速率开始降低。
A.刚刚反应开始的时候,乙酸乙酯水解产生醋酸,电离出的氢离子不断增加,反应速率不断加快,故A正确;B.B点和A点相比,发生水解的乙酸乙酯多,则A、B两点表示的c(CH3COOC2H5)A点大于B点,故B错误;C.图中to时表示乙酸乙酯水解速率最大,但没有达到平衡状态,故C错误;D.乙酸乙酯作为反应物不断减少,因此tB时CH3COOC2H5的转化率高于tA时CH3COOC2H5的转化率,故D错误,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,针对性强,注重答题的灵活性 ,有利于培养学生的逻辑推理能力和灵活应变能力,有助于激发学生的学习积极性。答题时注意根据图象分析影响因素以及速率变化特点。
本题难度:一般