微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
WI2(g) (I)。该反应在石英真空管中进行,如下图所示:
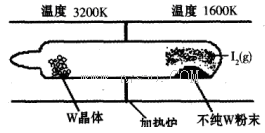
①反应(I)的平衡常数表达式K=_______,若K=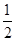 ,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②反应(I)的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质是_________。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)25℃时,NaHSO3的水解平衡常数=1.0×10-12mol/L,则该温度下H2SO3 HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=____mol/L,若向H2SO3溶液中加入少量的I2,则溶液中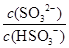 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
(3)直接排放含SO2的烟气会形成酸雨,危害环境。用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-): n ( HSO3-)
| 91:9
| 1:1
| 1:91
|
pH(25℃)
| 8.2
| 7.2
| 6.2
|
?
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为_________________________。
2、填空题 恒容容积为VL的密闭容器中发生2NO2 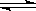 2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
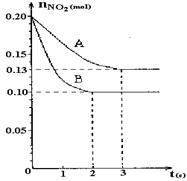
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是?。
A.有、无催化剂 ?B.温度不同
C.压强不同 ?D.体积不同
(2)写出该反应的化学平衡常数K的表达式:?,并比较K800℃?K850℃(填“>”、“<”或“=”)。
(3)求算在B条件下从反应开始至达到平衡,氧气的反应速率v(O2)=?。
(4)不能说明该反应已达到平衡状态的是?。
A.v正(NO2)=v逆(NO)?B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变?D.气体的密度保持不变

若起始温度相同,分别向三个容器中充入2molNO和1molO2 ,则达到平衡时各容器中NO物质的百分含量由大到小的顺序为(填容器编号)?。
3、选择题 反应4NH3(g) + 5O2(g) = 4NO(g)+ 6H2O(g)在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)可表示为
A.v(NH3)=0.01mol/L/s
B.v(O2)=0.001mol/L/s
C.v(NO)=0.001mol/L/s
D.v(H2O)=0.045 mol/L/s
4、选择题 一定条件下,某反应的化学方程式为:CO2+NO  ?NO2+CO ,下列说法正确的是(?)
?NO2+CO ,下列说法正确的是(?)
A.升高温度,正反应速率增大,逆反应速率减少
B.恒温时,压缩容器的体积,颜色加深,因平衡左移
C.达到平衡,其平衡常数为
D.恒容时,升高温度,混合气体的颜色加深,该反应的焓变为正值
5、填空题 在4L体积不变的密闭 容器中充入6molA气体和5molB气体,发生反应:
容器中充入6molA气体和5molB气体,发生反应:
3A (g) + B (g)? ?2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
?2C (g) + x D (g), 2分钟后反应达到平衡,生成了2molC,经测定D的浓度为0.25mol·L-1, 求:
(1) x= ?。
(2) 用B表示的2分钟内的平均反应速率______________________。
(3)达到平衡时 ,在相同温度下容器内混合气体的压强与反应前压强比为?。
,在相同温度下容器内混合气体的压强与反应前压强比为?。
(4)达到平衡状态时B的转化率为?。