|
高考化学必考知识点《氧化钠与过氧化钠》高频考点特训(2017年练习版)(二)
2017-08-08 06:04:39
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如下:
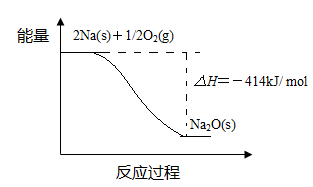
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是?。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是?(填字母)。
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
| (4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
②ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na  ?Ni + 2NaCl。其正极反应式是_____。 ?Ni + 2NaCl。其正极反应式是_____。
参考答案:(1)①放热?反应物总能量高于生成物总能量
② Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol?
(2)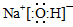 ?(3)B? C ?(3)B? C
(4)① 最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强。
②?NiCl2+ 2Na++ 2e-=Ni +2NaCl
本题解析:(1)①由于反应物的总能量比生成物的总能量高,所以发生的反应Ⅰ是放热反应。② 由题目提供的能量关系可得该反应的热化学方程式为:Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol。(2)反应Ⅱ是Na2O与水的反应,Na2O与水反应产生NaOH,反应的方程式为Na2O+H2O =2NaOH。NaOH的电子式为: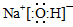 。(3)A.Na2CO3是强碱弱酸盐,在溶液中发生水解反应:Na2CO3+H2O 。(3)A.Na2CO3是强碱弱酸盐,在溶液中发生水解反应:Na2CO3+H2O NaHCO3+ NaOH。盐的水解反应是吸热反应,所以升高温度,促进盐的水解,溶液的碱性增强,溶液的pH增大。错误。B.根据电荷守恒可得c (H+)+ c (Na+)= c(OH-)+ c (HCO3-)+ 2c (CO32―);根据物料守恒可得c (Na+)=" 2" c (H2CO3)+ 2c (HCO3-)+ 2c (CO32―),两式相减,整理可得c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)。正确。C.加入少量NaOH固体,由于Na+物质的量增多。c (Na+)增大,c(OH-)增大,使平衡Na2CO3+H2O NaHCO3+ NaOH。盐的水解反应是吸热反应,所以升高温度,促进盐的水解,溶液的碱性增强,溶液的pH增大。错误。B.根据电荷守恒可得c (H+)+ c (Na+)= c(OH-)+ c (HCO3-)+ 2c (CO32―);根据物料守恒可得c (Na+)=" 2" c (H2CO3)+ 2c (HCO3-)+ 2c (CO32―),两式相减,整理可得c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)。正确。C.加入少量NaOH固体,由于Na+物质的量增多。c (Na+)增大,c(OH-)增大,使平衡Na2CO3+H2O NaHCO3+ NaOH逆向移动,所以c (CO32―)也增大。正确。D.Na2CO3=2Na++ CO32―;c (Na+) > c (CO32―);H2O+CO32- NaHCO3+ NaOH逆向移动,所以c (CO32―)也增大。正确。D.Na2CO3=2Na++ CO32―;c (Na+) > c (CO32―);H2O+CO32- OH-+HCO3-,所以c(OH―) > c (H+)。由于在溶液中还存在H2O OH-+HCO3-,所以c(OH―) > c (H+)。由于在溶液中还存在H2O H++ OH―。所以c? c(OH―) > (HCO3―) 。因此在溶液微粒的浓度关系为c (Na+) > c (CO32―) > c(OH―) > c (HCO3―) > c (H+)。错误。(4)①Na、Li都是第一主族的元素,由于原子半径Na>Li。原子半径越大,原子失去电子的能力就越强,因此钠比锂活泼。②由总方程式可知该电池的正极电极式为NiCl2+ 2Na++ 2e-=Ni +2NaCl;负极的电极式为2Na-2e-=2Na+. H++ OH―。所以c? c(OH―) > (HCO3―) 。因此在溶液微粒的浓度关系为c (Na+) > c (CO32―) > c(OH―) > c (HCO3―) > c (H+)。错误。(4)①Na、Li都是第一主族的元素,由于原子半径Na>Li。原子半径越大,原子失去电子的能力就越强,因此钠比锂活泼。②由总方程式可知该电池的正极电极式为NiCl2+ 2Na++ 2e-=Ni +2NaCl;负极的电极式为2Na-2e-=2Na+.
本题难度:一般
2、填空题 (12分)金属钠在氧气中充分燃烧生成产物是?色,将所得产物投入水中,产物和水迅速发生反应,写出该反应的化学方程式:?。向上所得溶液中加入FeSO4溶液,看到的现象:?,此过程中发生的氧化还原反应的化学方程式:?。
参考答案:(1)淡黄色?2Na2O2 + 2H2O ="=" 4NaOH+ O2 ↑?
(2)生成白色沉淀,迅速变灰绿色,最后变红褐色。
4Fe(OH)2 + O2 +2H2O ="=" 4Fe(OH)3
本题解析:略
本题难度:简单
3、选择题 下列关于实验操作或说法正确的是(? )
A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B.钠长期露置在空气中,最终产物是Na2CO3
C.以蒸发溶剂的方法,除去酒精溶液中少量的水分
D.用托盘天平称量25.20 g NaCl
参考答案:B
本题解析:大部分实验用剩的药品不能放回原瓶是避免污染瓶中的药品,但钠、钾等放置在空气或水中有危险的药品,剩下的一定要放回原瓶,防止发生危险。
本题难度:简单
4、选择题 钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是(?)
A.K与水反应比钠更剧烈,反应生成氢气和氢氧化钾
B.K易被空气中的氧气所氧化,氧化产物与其加热时燃烧产物相同
C.K与水能够反应,但不如Na与水的反应剧烈
D.K能从铝盐溶液中置换出铝
参考答案:A
本题解析:A钾与水比钠与水反应剧烈,反应生成氢氧化钾和氢气,A正确;C错误;B.K易被空气中的氧气所氧化生成K2O,加热时燃烧产物是KO2等,故B错误;D.钾与铝盐溶液反应生成氢氧化铝和氢气,故D错误;
本题难度:一般
5、选择题 把2.24 LCO2通过一定量的固体过氧化钠后收集到1.68L气体(气体测量均在标准状况下),则这1.68L气体的质量是?
A.3.0g
B.2.4g
C.2.8g
D.1.9g
参考答案:A
本题解析:根据方程式2Na2O2+2CO2=2Na2CO3+O2可知,如果2.24 LCO2完全反应,则生成气体是1.12L,这说明过氧化钠不足,CO2过量。根据差量法可知生成氧气2.24L-1.68L=0.56L,所以剩余CO2是1.68L-0.56L=1.12L,物质的量分别是氧气0.025mol。CO2是0.05mol,质量分别是0.8g和2.2g,所以答案选A。
本题难度:一般
|  ?Ni + 2NaCl。其正极反应式是_____。
?Ni + 2NaCl。其正极反应式是_____。