微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 科学家用NaNO3和Na2O在一定条件下化合制得由钠离子和阴离子B构成晶体NaxNO4,测定阴离子B中的各原子的最外层电子都达到了8电子稳定结构。下列说法错误的是
(?)
A.x="3"
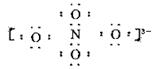
B.N的化合价为+3
C.阴离子B电子式可能为
D.此反应是非氧化还原反应
参考答案:B
本题解析:NaNO3+ (x-1)/2Na2O= NaxNO4,有O守恒则x=3;每个氮原子的价电子数为5,
每个氧原子的价电子数为6,1个NO43-离子中,含有1个氮原子和4个氧原子,并带3个
单位的负电荷,每个NO43-的电子总数为1×5+4×6+3=32,32可以写成4×8,根据题意可
知,Na3NO4中各原子最外层电子数都达到了8电子稳定结构,所以NO43-的
电子式为: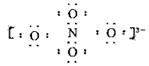 ?,氮的化合价为+5。
?,氮的化合价为+5。
本题难度:简单
2、选择题 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加
HCl溶液的体积之间关系如图所示,下列有关说法不正确的是
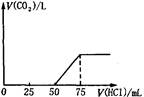
A.A溶液中溶质Na2CO3和NaHCO3物质的量比为1:1
B.A溶液中溶质NaOH和Na2CO3物质的量比为1:1
C.原NaOH溶液物质的量浓度为0.075mol/L
D.通入CO2气体在标况下的体积为56mL
参考答案:A
本题解析:
CO2与NaOH溶液反应有如下两种“边界”情况:
CO2+2NaOH=Na2CO3+H2O…①
CO2+NaOH=NaHCO3…②
故反应后溶液中溶质的成分可有如下可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;
当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的:
Na2CO3+HCl=NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④
并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等.
若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤
设反应产生CO2之前消耗盐酸的体积为V1,从开始产生CO2至反应结束消耗盐酸的体积为V2.
将各种反应的情况总结如下表:
溶液中溶质的成分
Na2CO3和NaOH
Na2CO3
Na2CO3和NaHCO3
NaHCO3
NaHCO3
向溶液中逐滴加入稀盐酸发生的反应
依次是⑤③④
依次是③④
依次是③④
④
④
V1与V2的关系
V1>V2
V1=V2
V1<V2
V1=0,V2>0
V1=0,V2>0
分析题中的图象:
(1)V1=50mL,V2=75mL-50mL=25mL<V1,据此判断溶液中溶质的成分是Na2CO3和NaOH.
根据上面⑤③④三个化学方程式可知,NaOH和Na2CO3的物质的量之比等于消耗盐酸的体积之比,则
n(NaOH):n(Na2CO3)=(75mL-50mL):25mL=1:1.
故A不正确,B正确;
(2)当加入盐酸75mL时,溶液溶质为NaCl,此时n(Na+)=n(HCl)=0.075mL×0.1mol·L-1=0.0075mol,
所以n(NaOH)=0.0075mol,
c(NaOH)=0.0075mol/0.1L
=0.075mol·L-1,
故C正确;
(3)50mL~75mL发生的反应为HCO3-+H+=H2O+CO2↑,n(HCl)=0.025L×0.1mol·L-1=0.0025mol,
则V(CO2)=0.0025mol×22.4L·mol-1=0.056L=56mL,
故D正确。
选A。
本题难度:简单
3、选择题 某学生运用所学知识研究钠的性质:将一粒金属钠和一块铜片分别盛在表面皿中,来研究它们在空气中的稳定性。该学生采用的研究方法是:(?)
①假说法 ②实验法?③分类法 ④比较法
A.①②
B.①③
C.②④
D.①③
参考答案:C
本题解析:将一粒金属钠和一块铜片分别盛在表面皿中,通过观察固体表面颜色的变化,来比较二者的稳定性,显然是比较法和实验发,答案选C。
本题难度:简单
4、填空题 (1)Na2CO3固体中混有少量NaHCO3固体,除去的方法是_____________,化学方程式为______________________________________________。
(2)NaHCO3溶液中混有少量Na2CO3,除去的方法是____________________,反应的离子方程式为_________________________________________。
(3)NaOH溶液中混有少量Na2CO3,除去的方法是_______________________,反应的离子方程式为_________________________________________。
(4)CO2中混有少量的SO2,除去的方法是________________________,反应的化学方程式为_____________________________________。
参考答案:(1)加热? 2NaHCO3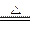 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(2)在溶液中通入过量CO2?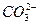 +CO2+H2O====2
+CO2+H2O====2
(3)滴入适量的Ca(OH)2溶液?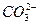 +Ca2+====CaCO3↓
+Ca2+====CaCO3↓
(4)将混合气体通入饱和NaHCO3溶液? SO2+2NaHCO3====Na2SO3+2CO2+H2O
本题解析:依据除杂原则选择除杂试剂。除杂质的试剂只能与杂质反应,且不引入新的杂质(如果有新杂质引入,新杂质必须较容易除去,如利用加热分解、挥发等)。
本题难度:简单
5、实验题 为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有?(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因?。
(2)装置C的作用是?。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①?;②?。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。
 Na2O2+
Na2O2+ HCl=
HCl= Cl2+
Cl2+ NaCl+
NaCl+ ?该反应?(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是?(要求答出两点)。
?该反应?(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是?(要求答出两点)。
参考答案:(1)Cl2 4H++4I-+O2=2I2+2H2O(或2H2O+4I-+O2=2I2+4OH
(2)吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气
(3)①Na2O2被还原时氧元素的化合价应该降低,不可能得到O2 ②O2有可能是Na2O2与盐酸中的H2O反应所得
(4)1 4 1 2 2H2O 不能 Na2O2与生成的H2O反应有O2生成;HCl混在Cl2中;H2O混在Cl2中;实验室没有可直接使用的干燥HCl气体;固体与气体反应较慢(答出任何两点即可)
本题解析:(1)B中湿润的红色纸条退色,说明A中反应有Cl2生成;若B中是湿润的淀粉KI试纸变蓝,不能说明一定有Cl2生成,因为O2也可把I-氧化成I2:4H++4I-+O2=2I2+2H2O,从而使试纸变蓝。(2)装置C中盛放的是NaOH溶液,其作用是吸收HCl和Cl2,防止污染空气并使D中收集到较纯净的O2。(3)Na2O2被还原时氧元素的化合价应该降低,不能得到O2;O2可能是Na2O2与盐酸中的H2O反应得到的。(4)由元素守恒可知,生成物中所缺物质为H2O,再根据得失电子守恒、原子守恒可配平该反应的化学方程式。该反应不能用于实验室快速制取纯净的Cl2,一是因为实验室没有可直接使用的干燥HCl气体,且气体与固体反应较慢;二是因为HCl易混入Cl2中,生成的H2O及H2O与Na2O2反应生成的O2也易混入Cl2中,使Cl2不纯。
本题难度:一般