微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
已知:Si+2NaOH+H2O = Na2SiO2+2H2↑,2Al+2NaOH+2H2O = 2NaAlO2+3H2↑,有一块粗铝,含有铁和硅两种杂质。取两份等质量的样品分别放入足量的稀盐酸和稀NaOH溶液中,放出等质量的H2,则该粗铝中铁和硅的关系是
[? ]
①物质的量之比为1:2②物质的量之比是3:1③质量之比是2:1 ④质量之比是4:1
A.②④
B.②③
C.①④
D.只有④
参考答案:D
本题解析:
本题难度:一般
2、选择题 铝可与硝酸钠发生反应:Al+NaNO3+H2O→Al(OH)3↓+N2↑+NaAlO2(未配平),下列有关上述反应的叙述正确的是
A.该反应中的氧化剂是水
B.若反应过程中转移5?mol电子,则生成标准状况下N2的体积为11.2?L
C.该反应中的氧化产物是N2
D.当消耗1?mol Al时,生成标准状况下N2的体积为22.4?L
参考答案:B
本题解析:分析:Al+NaNO3+H2O→Al(OH)3↓+N2↑+NaAlO2中,Al元素的化合价升高,N元素的化合价降低,以此来解答.
解答:A.水中H、O元素的化合价不变,则不作氧化剂,故A错误;
B.由N元素的化合价变化+5→0可知,生成1molN2转移10mol电子,则转移5mol电子,则生成标准状况下N2的体积为0.5mol×22.4L/mol=11.2L,故B正确;
C.因N元素的化合价降低,则还原产物为N2,故C错误;
D.由电子守恒可知,10molAl反应生成3molN2,则消耗1molAl时,生成标准状况下N2的体积为0.3mol×22.4L/mol=6.72L,故D错误;
故选B.
点评:本题考查氧化还原反应,明确反应中元素的化合价变化是解答本题的关键,题目难度不大.
本题难度:一般
3、选择题 100?mL溶质为 的混合溶液,其中
的混合溶液,其中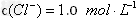 ,
,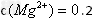
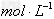 。若不考虑水解因素,则要使其中的
。若不考虑水解因素,则要使其中的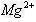 全部转化为
全部转化为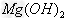 沉淀而分离出来,至少需要4
沉淀而分离出来,至少需要4
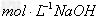 溶液的体积是
溶液的体积是
[? ]
A.30?mL
B.5?mL
C.25?mL
D.100?mL?
参考答案:A
本题解析:
本题难度:一般
4、选择题 甲、乙两烧杯中各盛有100 ml3 mol/L的盐酸及NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成气体的体积比为甲∶乙=1∶2,则加入铝粉的质量为:
A.5.4 g
B.3.6 g
C.2.7 g
D.1.8 g
参考答案:A
本题解析:
本题难度:困难
5、计算题 将8.8gFeS固体置于200mL2.0mol/L的盐酸中,以制取H2S气体反应完全后,若溶液中H2S的物质的量浓度为0.1mol/L,假设溶液的体积不变,试计算:
(1)收集到H2S气体的体积为_______________(标准状况)
(2)溶液中Fe2+和H+的物质的量浓度。
参考答案:(1)1.792L
(2)解:FeS + 2HCl = FeCl2 + H2S ↑
88g 2mol
8.8g 0.21L×2.0mol/L

所以盐酸过量
n(Fe2+) = n (FeCl2)= n (FeS) = 8.8g ÷ 88g/mol =0.10mol
c(Fe2+) = 0.10mol ÷ 0.20L =0.50 mol/L
n(H+ ) = n (HCl )总 -n (HCl )反应
= n (HCl )总 -2n (FeCl2 )= 0.21L×2.0 mol/L-2× 0.10mol =0.20mol
c(H+) = 0.20mol ÷ 0.20L = 1.0mol/L
答:溶液中Fe2+和H+的物质的量浓度分别为0.50mol/L和1.0mol/L
本题解析:
本题难度:一般