微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知A、B、C、D、E、F、G、H是原子序数依次增大的八种元素,A元素是周期表中原子半径最小的元素,B、C和D同周期,E、F和G同周期,A、E?同主族,D、G、H同主族且相邻,B的低价氧化物与C单质分子的电子总数相等,F和G的核电荷数相差4,G的2价简单离子与Ar原子的电子层结构相同.根据以上信息填空:
(1)G元素的二价离子的离子结构示意图为______;H的元素符号为______,H元素在周期表中的位置是______.
(2)C的气态氢化物空间构型是______;A和B形成的四原子非极性分子的结构式是______.
(3)据报道,含题中所述元素B、F和Ni三种元素的晶体具有超导性.该晶体的晶胞结构如图,试写出该晶体的化学式______

(4)由A、C、D、G四种元素形成的强酸的酸式盐的水溶液中各离子浓度由大到小的顺序为______.
(5)科学家用C、D、E三种元素形成的化合物ECD3和E2D,在573K时反应制得了离子化合物E3CD4;经测定E3CD4中各原子的最外层电子都达到了8电子稳定结构,则CD43-的电子式为______,E3CD4与水能剧烈反应转化为常见物质,写出反应的化学方程式:______.
参考答案:A元素是周期表中原子半径最小的元素,故A为H,G的2价简单离子与Ar原子的电子层结构相同,D、G、H同主族且相邻,故G为S,D为O,H为Se,A、E?同主族,则E为Na,B的低价氧化物与C单质分子的电子总数相等,则C为N,B为C,F和G的核电荷数相差4,故F为Mg,
(1)硫离子结构示意图为
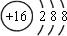
,H的元素符号为 Se,位于第四周期第ⅥA族,故答案为:
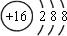
;Se;第四周期第ⅥA族;
(2)氨气的空间结构为三角锥形,碳和氢形成的四原子非极性分子即为乙炔,结构式是:H-C≡C-H,故答案为:三角锥形;H-C≡C-H;
(3)根据晶体的晶胞结构,每个晶胞含有一个Mg,含有Ni个数为:6×12=3,含有C个数为:8×18=1,故该晶体的化学式为:MgCNi3,故答案为:MgCNi3;
(4)硫酸氢铵属于易溶于水的盐,NH4HSO4═NH4++H++SO42-,铵根离子易水解,溶液中的氢离子还有水电离的一小部分,故离子浓度大小顺序为:c(H+)>c(SO42-)>c(NH4+)>c(OH-),故答案为:c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(5)NO43-中的化学键全部为共价键,Na3NO4与水反应时,转化为常见物质,根据原子守恒,得到方程式为:Na3NO4+H2O═NaNO3+2NaOH,故答案为:
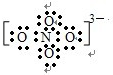
,Na3NO4+H2O═NaNO3+2NaOH.
本题解析:
本题难度:一般
2、简答题 A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02g?H2,用去0.4g?A.B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体.
(1)写出两种元素的名称:A______,B______.
(2)用电子式表示A、B形成的化合物中化学键的形成过程______.
参考答案:因A元素的最高价离子0.5mol被还原成中性原子时,要得到6.02×1023个电子即1摩尔电子,说明它的化合价为+2;单质同盐酸充分反应时,放出0.02g?H2即0.01mol,用去0.4g?A,由关系式:A~H2,可知:A的物质的也为0.01mol,A的摩尔质量为40g/mol,所以A的相对原子质量为40,故A为钙;因B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体,所以B是溴.
(1)A、B两元素的名称分别为:钙、溴,故答案为:钙;溴;
(2)用电子式表示溴化钙的形成过程:
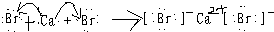
,故答案为:
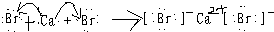
.
本题解析:
本题难度:一般
3、简答题 A、B、C、D四种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)A、B、C、D四种元素的符号分别为______、______、______、______;
(2)A、B形成的化合物的化学键类型______;
(3)C的最高价氧化物的化学式______;
(4)D的最高价氧化物对应的水化物的化学式______.
(5)写出C的气态氢化物与D的最高价氧化物对应的水化物反应的化学方程式:______.
参考答案:A、B、C、D四种元素,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,即C为S元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,D在第四周期第ⅠA族,即D为K,
(1)由上述推断可知,A为H,B为N,C为S,D为K,故答案为:H;N;S;K;
(2)A、B形成的化合物为氨气,存在N-H共价键,故答案为:共价键;
(3)S的最高价为+6价,则最高价氧化物为SO3,故答案为:SO3;?
(4)K的最高价为+1价,则D的最高价氧化物对应的水化物的化学式为KOH,故答案为:KOH;
(5)C的气态氢化物为H2S,D的最高价氧化物对应的水化物为KOH,则二者反应的化学方程式为H2S+2KOH=K2S+2H2O,故答案为:H2S+2KOH=K2S+2H2O.
本题解析:
本题难度:一般
4、简答题 有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体;B原子最外层电子数是次外层电子数的3倍,C?2+与B元素的离子具有相同的电子层结构;D与E原子具有相同的电子层数,且次外层电子数均为8;在同周期主族元素中原子半径E最大,D最小.回答下列问题:
(1)C?2+离子与D原子的结构示意图分别为:______、______.
(2)B和E形成的两种化合物的电子式是:______、______
其中之一可与A?和B形成的化合物反应得到游离态B,写出该反应的化学方程式:______.
(3)由这五种元素中的几种形成的化合物中碱性最强的是______(化学式),含氧酸酸性最强的是______(化学式).
参考答案:有A、B、C、D、E五种短周期元素,A元素的一种同位素原子核内不含中子,其单质为气体,则A为H元素;B原子最外层电子数是次外层电子数的3倍,则最外层电子数为6,即B为O元素;C?2+与B元素的离子具有相同的电子层结构,则C的质子数为8+2+2=12,即C为Mg元素;D与E原子具有相同的电子层数,且次外层电子数均为8,则D、E均在第三周期,在同周期主族元素中原子半径E最大,D最小,则E为Na,D为Cl,
(1)镁离子的结构示意图为
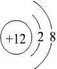
,氯原子的结构示意图为

,故答案为:

;

;
(2)B和E形成的两种化合物为Na2O、Na2O2,电子式分别为
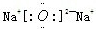
、
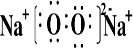
,过氧化钠与水反应生成氧气,反应的化学方程式为
2Na2O2+2H2O=4NaOH+O2↑,
故答案为:
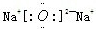
;
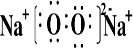
;2Na2O2+2H2O=4NaOH+O2↑;
(3)五种元素中,Na的金属性最强,则NaOH的碱性最强;Cl的非金属性最强,则HClO4的酸性最强,
故答案为:NaOH;HClO4.
本题解析:
本题难度:一般
5、简答题 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
(1)下列叙述正确的是______.(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个?键和1个大π键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元?素 | Mn | Fe
|
电离能
/kJ?mol-1
I1
717
759
I2
1509
1561
I3
3248
2957
|
Mn元素价电子排布式为______,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是______.
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于______区.
(4)Ti的一种氧化物X,其晶胞结构如上图所示,则X的化学式为______.
(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2.
①H、C、N、O四种元素的电负性由小到大的顺序为______.
②与CNO-互为等电子体微粒的化学式为______(写出一种即可).
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式______.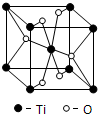
参考答案:(1)A中甲醛中含有羟基,与水可以形成氢键,故A正确;B二氧化碳为sp杂化,C中苯中碳碳键含有6个σ键,每个碳氢键含有一个σ键,苯分子中一共含有12个,故C错误;常温下二氧化碳为气体,二氧化硅为固体,CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确;
故答案为:(1)A?D;
(2)25号元素锰,价电子个数为25-18=7,价电子排布为3d54s2,Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转变为不稳定的3d4状态,而铁为26号元素,价电子排布为3d64s2,Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态,故气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难;
故答案为:3d54s2; Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转σσ变为不稳定的3d4状态,而Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态;
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,s区、d区、ds区、p区、f区,s区为第ⅠA、ⅡA族,p区为第ⅢA到零族,d区包括从第ⅢB族到八族,ds区为第ⅠB、ⅡB族,f区为镧系和锕系,其中钛位于第ⅣB族,属于d区;?
故答案为:d区;
(4)每个晶胞中含有钛原子数为8×0.125+1=2,氧原子数为4×0.5+2=4,故化学式为TiO2;
故答案为:TiO2;
(5)①氢位于第一周期,碳、氮、氧元素位于第二周期,同周期从左向右,电负性逐渐增大,故电负性大小为H<C<N<O;
②CNO-电子数为22,等电子体为电子数相等,故与CNO-互为等电子体微粒的化学式CO2、N2O、SCN-等;
③氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,碳为四配位,氮为三配位,氧为两配位,故N≡C-O-H;
故答案为:①H<C<N<O? ②CO2(N2O)、SCN-③N≡C-O-H.
本题解析:
本题难度:一般