微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知N2 (g) + 3H2(g) 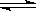 2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是
2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是
①只有在此温度下反应才能发生?②升高温度有利于NH3的合成
③提高反应速率,以提高单位时间内NH3的产量?④使催化剂达到最佳催化活性
A.③④
B.①②
C.①③
D.②④
2、选择题 进行如下实验,在A锥形瓶中放入10g绿豆大小的碳酸钙,在B锥形瓶中放入5g粉末状的碳酸钙,分别加入50mL?1mol/L盐酸,下图中能正确表示实验结果的是(注:x一时间、y-锥形瓶中碳酸钙减少的质量)( )
A.
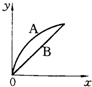
B.
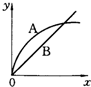
C.
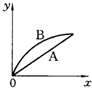
D.

3、选择题 下述实验不能到达预期目的的是
编号
| 实验内容
| 实验目的
|
A
| 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水浴加热
| 检验蔗糖是否已水解
|
B
| 将Cl2通入NaBr溶液中
| 比较氯气与溴的氧化性强弱
|
C
| 将铜与浓硝酸反应生成的气体收集后,用冰水混合物冷却降温
| 研究温度对化学平衡的影响
|
D
| 分别向2支试管中加入相同体积、不同浓度的H2O2溶液,再向其中1支加入少量MnO2
| 研究催化剂对H2O2分解速率的影响
4、选择题 对于可逆反应:2A(g)+B(g)  ?2C(g); △H<0,下列各图正确的是 ?2C(g); △H<0,下列各图正确的是
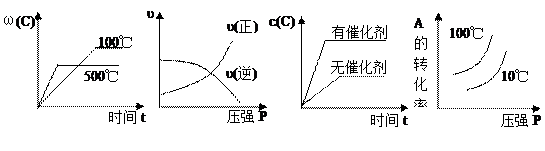
A? B? C? D
5、填空题 某同学探究外界条件对H2O2分解速率的影响,所用H2O2浓度为5%、10%,实验温度为20℃、40℃,其他试剂有1mol/LFeCl3溶液.每次实验H2O2的用量为2mL,FeCl3溶液2滴.
(1)请完成以下实验设计表:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的
①
20
5
无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响;
(Ⅱ)实验②和③探究温度对该反应速率的影响;
(Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响.
②
20
5
FeCl3溶液
③
______
______
______
④
______
______
______
|
(2)实验④产生气泡的速率比实验②快.分析引起反应速率差异的原因是______.
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:______.
控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80
铜的平均溶解速率
(×10-3mol/(L?min))
7.34
8.01
9.25
7.98
7.24
6.73
5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:______.
|