微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
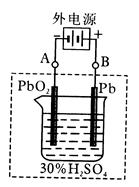
1、选择题 (12分)铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,电池总反应式为:
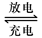 Pb+PbO2+4H++2SO42-?2PbSO4+2H2O
Pb+PbO2+4H++2SO42-?2PbSO4+2H2O
回答下列问题(不考虑氢、氧的氧化还原)
(1)放电时:正极的电极反应式是?;电解液中H2SO4的浓度将变________,当外电路通过1.5mol电子时,理论上负极板的质量增加_______________g。
(2)在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
参考答案:(1)PbO2 + 2e- + 4H+ +SO42- = PbSO4 + 2H2O?小? 72 (2)Pb; PbO2;对换
本题解析:略
本题难度:简单
2、选择题 有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(
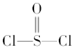
)中而形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1
参考答案:A.锂性质活泼,易与水反应,则电解质为非水溶液,故A错误;
B.该电池的负极材料为锂,被氧化生成LiCl和Li2SO3,故B错误;
C.根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,亚硫酰氯(SOCl2)被还原为S,故C错误;
D.根据总反应8Li+3SOCl2=6LiCl+Li2SO3+2S可知,8mol锂反应失去8mol电子,生成2molS,金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确.
故选D.
本题解析:
本题难度:简单
3、填空题 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示:两个电极均由多孔碳制成,通入的气体由孔隙中流出,并从电极表面放出。
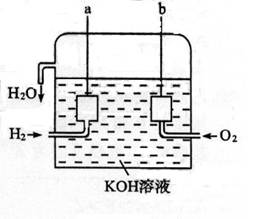
⑴a极是?,电极反应式是?。
⑵b极是?,电极反应式是?。
⑶氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如甲烷(天然气)、汽油等。请写出甲烷燃料电池中a极的电极反应式为?。此时电池内的总反应方程式为?。
参考答案:⑴负极,2H2+4OH-→4H2O+4e-;⑵正极,O2 + 2H2O + 4e-→ 4OH-;⑶CH4+10OH-= CO32-+ 7H2O + 8 e-,CH4+2O2+2KOH = K2CO3?+? 7H2O 。
本题解析:依据燃料电池的电极及电极反应可知a、b两极各是什么极及其电极反应式。又由于甲烷燃烧生成二氧化碳,但在KOH溶液中应生成碳酸根离子,又碳元素的化合价由-4升到+4,故1mol的甲烷应失去8mol的电子,即电极反应式为:CH4+10OH-= CO32-+ 7H2O + 8 e-。
本题难度:一般
4、选择题 下列有关说法正确的是
A.铅蓄电池放电时,正极和负极的电极质量均增大
B.反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H>0
C.加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大
D.C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变