微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)选择合适的药品,把下列物质中含有的少量杂质(括号内为杂质)除去,写出所需的药品和有关的离子方程式。
物质(杂质)
| 除杂药品
| 离子方程式
|
NaHCO3溶液(Na2CO3)
| ?
| ?
|
CO2(HCl)
| ?
| ?
|
FeCl2溶液(FeCl3)
| ?
| ?
|
FeCl3溶液(FeCl2)
| ?
| ?
参考答案::
过量CO2
CO2+CO32-=HCO3?-
饱和NaHCO3溶液
H++HCO3?-=" " CO2↑+H2O
Fe
Fe+2Fe3+=3Fe2+
Cl2或H2O2
2Fe2++Cl2=2Fe3++2Cl-
本题解析:NaHCO3溶液(Na2CO3):通入过量的二氧化碳,使碳酸钠转化为碳酸氢钠。除去杂质而不引入新的杂质。CO2+CO32-=HCO3?-。
CO2(HCl):通过饱和NaHCO3溶液使盐酸与碳酸氢钠反应生成二氧化碳气体,除去杂质而不引入新的杂质。H++HCO3?-= CO2↑+H2O。
FeCl2溶液(FeCl3):加入铁粉使氯化铁转化为氯化亚铁,除去杂质而不引入新的杂质。Fe+2Fe3+=3Fe2+。
FeCl3溶液(FeCl2):加入Cl2或H2O2使氯化亚铁被氧化成氯化铁,除去杂质而不引入新的杂质。2Fe2++Cl2=2Fe3++2Cl-。
点评:掌握不同物质的性质是解决这类题目的关键。还要注意除去杂质而不引入新的杂质原则。
本题难度:一般
2、填空题 钒及化合物用途广泛。工业上常用含少量Al2O3的钒铁矿(FeO×V2O5)碱熔法提取V2O5。简要流程如下:

已知:①焙烧时可发生反应:V2O5 + Al2O3+2Na2CO3 2NaVO3 +2NaAlO2 +2CO2? 2NaVO3 +2NaAlO2 +2CO2?
②常温下物质的溶解度:NaVO3~21.2 g /100g水;HVO3~0.008 g /100g水
(1)“浸出渣B”的主要成分是?。(写化学式)
(2)生产中,不直接用H2SO4浸泡“烧渣A”获取HVO3的原因是?。
(3)“操作①”包括?、洗涤。如果不洗涤,则产品中可能含有的金属阳离子是?、?。下列装置(部分夹持仪器省去)可用在实验室进行“操作②”的是?。(填序号)
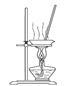 ? ? ? ?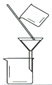 ? ?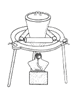
A? B? C? D
(4)NaVO3用于原油的脱硫技术,由V2O5溶于NaOH溶液中制取,反应的离子方程式为?。
参考答案:(1)Fe2O3或Fe3O4,或者Fe2O3和Fe3O4?(2分)?
(2)H2SO4与NaVO3反应生成难溶的HVO3,HVO3包裹在一些烧渣的表面,阻碍了反应的进行,从而降低了HVO3产率,且使产生的HVO3不纯。另外,铁的氧化物会和硫酸反应生成铁离子,增加干扰离子,消耗硫酸,浪费资源。(4分)
(3)过滤(2分)? Na+、Al3+(2分)? D (2分)
(4)V2O5?+2OH 2VO3-+ H2O?(2分)(可以没有加热符号) 2VO3-+ H2O?(2分)(可以没有加热符号)
本题解析:(1)依题意,焙烧时不仅发生反应:V2O5+Al2O3+2Na2CO3?=2NaVO3+2NaAlO2+2CO2↑,而且FeO被空气中的氧气氧化为氧化铁(或四氧化三铁或既有氧化铁又有四氧化三铁),因为+2价的铁元素在高温下易被氧化;由于加入的碳酸钠过量,则氧化铝、五氧化二钒全部转化为可溶性的钠盐,加入足量水浸取时,铁的氧化物难溶于水,则浸出渣B的主要成分是Fe2O3或Fe3O4,或者Fe2O3和Fe3O4;(2)由已知信息②可知,H2SO4与NaVO3反应生成难溶的HVO3,HVO3包裹在一些烧渣的表面,阻碍了反应的进行,从而降低了HVO3产率,且使产生的HVO3不纯;另外,铁的氧化物会和硫酸反应生成铁离子,增加干扰离子,消耗硫酸,浪费资源,因此不采取硫酸浸取烧渣;(3)由于HVO3的溶解度很小,HVO3难溶于水,从浸出液中分离难溶物的方法是过滤、洗涤,由此确定操作①的方法;如果不洗涤,HVO3吸附了可溶性的硫酸钠、硫酸铝典礼处的钠离子和铝离子;HVO3是难溶性酸,与硅酸类似,受热可以分解,加热固体物质只能在坩埚中进行实验,因此选D;(4)五氧化二钒与NaOH溶液反应生成钒酸钠和水,不涉及氧化还原反应,说明五氧化二钒具有酸性氧化物的性质,氧化物应保留化学式,则该反应为V2O5?+2OH-?=?2VO3-+ H2O;
本题难度:困难
3、选择题 下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的是
[? ]
X
?Y
?Z
A.
FeCl2溶液?
FeCl3
Fe
B.
FeCl3溶液
CuCl2
Fe
C.
Fe?
Al
NaOH溶液
D.
Na2SO4溶液
Na2CO3
BaCl2溶液
参考答案:AC
本题解析:
本题难度:一般
4、填空题 (12分)现有一包AlCl3和FeCl3的混合粉末,欲将其中的Al元素和Fe元素分开,可进行如下操作:

(1) 操作①名称是?,操作②名称是?(过滤/分液/蒸馏/溶解/结晶);
(2)溶液B是?,沉淀C是?
(3)若往溶液A中滴入KSCN溶液,预计会观察到溶液呈?色;
(4)请写出在溶液中,FeCl3和NaOH反应的离子方程式:
?
参考答案:(1) 溶解;过滤? (2) NaAlO2或 Na[Al(OH)4] ;Fe(OH)3
(3)血红色;? (4) Fe3++3OH-=Fe(OH)3↓
本题解析:考查物质的分离、提纯及检验。由于氢氧化铝是两性氢氧化物,既能溶于强碱,又能溶于酸中,据此可以将氯化铁和氯化铝分离。固体首先溶解,然后加入过量的氢氧化钠溶液,生成氢氧化铁沉淀和偏铝酸钠。过滤即得到氢氧化铁沉淀,加入盐酸即得到氯化铁。检验铁离子可以用KSCN溶液,现象是溶液显血红色。
本题难度:一般
5、选择题 下列有关实验原理或操作正确的是( ) A.
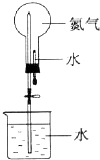
喷泉实验
B.
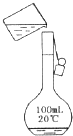
转移溶液
C.
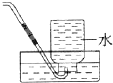
收集氯化氢气体
D.
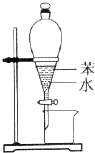
分离苯和水
参考答案:A.氮气不溶于水,无法形成喷泉,故A错误;
B.转移溶液需要用玻璃棒引流,故B错误;
C.氯化氢极易溶于水,不能用排水法收集,故C错误;
D.苯和水互不相溶,能分层,能用分液漏斗分离,故D正确.
故选D.
本题解析:氮气难溶于水,不能形成喷泉,A不正确。向容量瓶中转移液体时,需要用玻璃棒,B不正确。氯化氢极易溶于水,C不正确。苯不溶于水,分液即可,所以正确的答案选D。
本题难度:简单
|
网站客服QQ: 960335752 - 14613519 - 791315772