微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)填空回答:
(1)氮化硅是一种高温陶瓷材料。根据元素周期律知识,写出氮化硅的化学式:??。
(2)有A、B、C、D、E、F六种元素,它们均属短周期元素,其原子序数依次增大,它们两两形成的化合物有以下几种:
形成的化合物
| 甲
| 乙
| 丙
| 丁
| 戊
|
化合物中各元素的原子个数比
| A:C=1:1
| B:A=1:3
| D:C=1:1
| E:F=1:3
| A:F=1:1
|
已知A、B两元素的核电荷数之差等于其原子最外层电子数之和;B原子最外层电子数比次外层电子数多3个;C原子的最外层电子数是次外层电子数的3倍;D、E、F同周期,D、A同主族;E与F的原子序数之和为30,丙是离子化合物。回答:
① F元素位于周期表中的位置??。
② E元素的原子结构示意图为?,乙的电子式为??,丙的电子式为??,B的最高价氧化物的水化物的化学式为?。
③向甲的水溶液中加入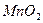 ,反应的化学方程式为?。
,反应的化学方程式为?。
参考答案:(1)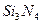 (1分)
(1分)
(2)①第三周期第VIIA族(1分)?
②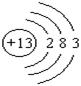 (1分)?
(1分)?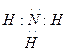 ?(2分)?
?(2分)?
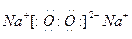 (2分)?
(2分)?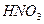 (1分)
(1分)
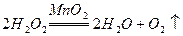 (2分)
(2分)
本题解析:略
本题难度:简单
2、推断题 (7分)从某物质A的水溶液出发有下图所示的一系列变化:
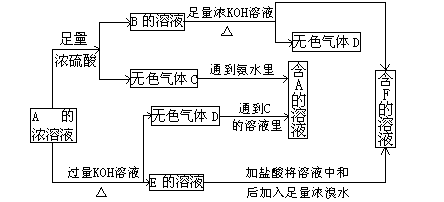
(1)写出下列物质的化学式:
A? ?、C? ?、F? ?。
(2)写出下列反应的离子方程式
A→E________________________;
E→F________________________。
参考答案:(7分)(1)化学式为:A是(NH4)2SO3,C是SO2, F是K2SO4。(每空1分)
(2)(每空2分)A→E: NH4++OH-=NH3↑+H2O;
E→F:? SO32-+Br2+H2O=SO42-+2H++2Br-
本题解析:A既能和强酸反应生成气体,也能和强碱反应生成气体,所以A一定是弱酸的铵盐。则D是氨气,B是硫酸铵。B和氢氧化钾反应生成氨气和F,则F是硫酸钾。又因为E能和溴水反应生成F,这说明E中的酸根应该是亚硫酸根,被溴水氧化生成硫酸根,则A是亚硫酸铵。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
3、填空题 A、B、C、D、E是中学常见的5种化合物,A、B是金属氧化物且A是红棕色固体,元素X、Y、Z是中学化学中常见的单质,相关物质间的关系如下图所示。
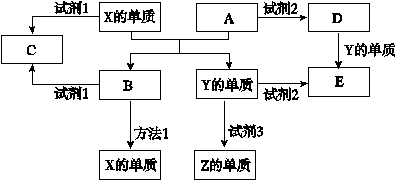
(1)工业上得到单质X的冶炼方法1是?。
(2)单质X与试剂1、单质Y与试剂2都能产生Z单质,试剂3是生活中常见的液体,请写出Y与试剂3 反应的化学方程式是?。
(3)若试剂1是NaOH溶液,单质X与试剂1反应的离子方程式?。
(4)若试剂2是盐酸。
①如何检验D物质中的金属阳离子?。
②将D的饱和溶液滴加到沸水中得到有丁达尔效应的分散系,用离子方程式和平衡移动理论说明产生这种分散系的原因?。
参考答案:(9分)
(1)电解(1分)
(2)3Fe+4H2O(g)= Fe3O4+4H2(2分)
Fe3O4+4H2(2分)
(3)2Al+2OH-+2H2O==2AlO2 -+3H2↑(2分)
(4)①取少量D溶液于试管中,再向试管中滴加少量的硫氰化钾溶液,若溶液显红色,则D物质中的金属阳离子是Fe3+。(2分)
②D溶液存在Fe3++3H2O Fe(OH)3+3H+水解平衡,且正反应是吸热反应,当其滴加到沸水中时使平衡向正向移动,产生大量的Fe(OH)3凝结成胶体颗粒,而有丁达尔效应。(2分)
Fe(OH)3+3H+水解平衡,且正反应是吸热反应,当其滴加到沸水中时使平衡向正向移动,产生大量的Fe(OH)3凝结成胶体颗粒,而有丁达尔效应。(2分)
本题解析:A是金属氧化物且A是红棕色固体,则A是氧化铁,A和X发生置换反应生成B,B是金属氧化物,则该反应是铝和氧化铁发生铝热反应,则X是铝,Y是铁,B是氧化铝,铝和氧化铝都与试剂1反应生成C,用电解氧化铝的方法冶炼铝;Al、氧化铝都既能与酸反应又能与碱反应,而Fe、氧化铁都能与酸反应,则试剂1为NaOH溶液时,C为偏铝酸钠;试剂2为盐酸时,D为氯化铁、E为氯化亚铁;
(1)工业采用电解熔融氧化铝的方法冶炼铝,故答案为:电解;
(2)单质X与试剂1、单质Y与试剂2都能产生Z单质,则Z是氢气,试剂3是生活中常见的液体,则为水,高温下,铁和水蒸气反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g) .Fe3O4+4H2,
.Fe3O4+4H2,
答案为:3Fe+4H2O(g) Fe3O4+4H2;
Fe3O4+4H2;
(3)若试剂1是NaOH溶液,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)若试剂2是盐酸,
①氧化铁和盐酸反应生成氯化铁,铁离子和硫氰化钾溶液反应生成血红色溶液,检验方法为:取少量D溶液于试管中,再向试管中滴加少量的硫氰化钾溶液,若溶液显红色,则D物质中的金属阳离子是Fe3+,
答案为:取少量D溶液于试管中,再向试管中滴加少量的硫氰化钾溶液,若溶液显红色,则D物质中的金属阳离子是Fe3+;
②氯化铁是强酸弱碱盐,易水解生成氢氧化铁,且盐类的水解反应是吸热反应,升高温度促进盐类水解,从而产生大量的Fe(OH)3凝结成胶体颗粒,而有丁达尔效应,
答案为:D溶液存在Fe3++3H2O Fe(OH)3+3H+水解平衡,且正反应是吸热反应,当其滴加到沸水中时使平衡向正向移动,产生大量的Fe(OH)3凝结成胶体颗粒,而有丁达尔效应.
Fe(OH)3+3H+水解平衡,且正反应是吸热反应,当其滴加到沸水中时使平衡向正向移动,产生大量的Fe(OH)3凝结成胶体颗粒,而有丁达尔效应.
考点?:无机物的推断.
本题难度:困难
4、简答题 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.
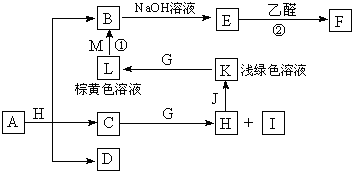
据此回答下列各题:
(1)写出纯净物A的化学式______,C的电子式______,用来检验L中阳离子的试剂是______(该试剂焰色为紫色).
(2)沉淀E可溶于过量______(填试剂名称)得到深蓝色的透明溶液,呈现该颜色是因为溶液中存在配离子______(填化学式).
(3)写出反应①的离子方程式______,写出反应②的化学方程式(有机物用结构简式表示)______.
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体,请写出该反应的化学方程式______.
参考答案:X在周期表中的原子半径最小,为H元素,Y、Z原子最外层电子数之和为10,“X、Y、Z的原子序数依次增大”,进而推出D(由H、C、O中的两种元素组成;无色非可燃性气体)为CO2,可以知道X、Y、Z是H、C、O,则C为H2O,H为HCl,I有漂白作用,应为HClO,浅绿色、棕黄色溶液为Fe2+和Fe3+,可知J为Fe,K为FeCl2,L为FeCl3,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,B为CuCl2,E能与乙醛反应,应为Cu(OH)2,F为Cu2O,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,应为CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3,
(1)由以上分析可知A是CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3,C为H2O,电子式为
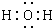
,L为FeCl3,用来检验L中阳离子的试剂是硫氰化钾,
故答案为:CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3;
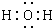
;硫氰化钾;
(2)E为Cu(OH)2,可与氨水发生络合反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,
故答案为:氨水;[Cu(NH3)4]2+;
(3)反应①为氯化铁和铜的反应,反应的离子方程式为Cu+2Fe3+═Cu2++2Fe2+,乙醛和氢氧化铜浊液在加热的条件下反应的方程式为CH3CHO+2Cu(OH)2+NaOH△
本题解析:
本题难度:一般
5、填空题 (10分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色,各物质的转化关系如下图,(部分反应产物已略去).
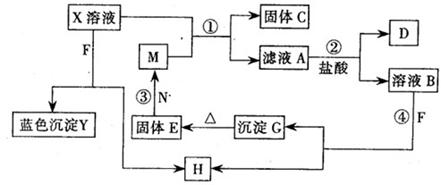
请回答下列问题;
(1)E的化学式为?
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是:?
(3)在反应①②③④中属于置换反应的是??(填序号).
(4)反应②的离子方程式为?
(5)用石墨作电极电解500mL X溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;电解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1. 6g.请回答下列问题:
①写出电解时的阳极反应式??
②电解后溶液的pH为?假设电解前后溶液体积不变)
参考答案:(1)Fe2O3(1分)
(2)铁丝上附有红色物质,溶液颜色逐渐变为浅绿色(2分)
(3)①③(2分,每项1分,漏选一项扣1分,错选一项不得分)
(4) 3Fe2++NO3-? +4H+= 3Fe3+? +NO ↑? +2H2O(2分)
(5)? 4OH-=O2↑? +2H2O +4e-(或4OH- -4e- =O2↑+2H2O(2分)? 1(1分)
本题解析:略
本题难度:简单