微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
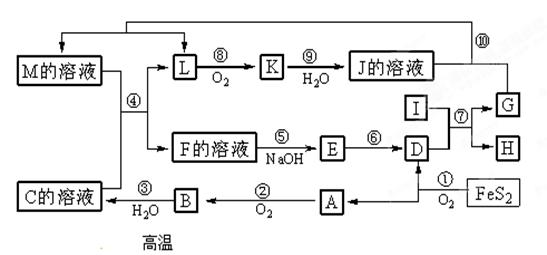
1、填空题 ( 8分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属, K是一种红棕色气体。
 (提示:4FeS2+11O2
(提示:4FeS2+11O2 2Fe2O3+8SO2)
2Fe2O3+8SO2)
请填写下列空白:
⑴ 在周期表中,组成单质G的元素位于第___? _?_周期_________族。
⑵ 在反应⑦中氧化剂与还原剂的物质的量之比为___________________。
⑶ 在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是___________(填序号)
⑷ 反应④的离子方程式是:______________________________________________。
⑸ 将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:__________________________________。
参考答案:(1)四(或4);Ⅷ?(2)1:2?(3)③?
(4)3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O?
(5)Fe2O3+3KNO3+4KOH =2K2FeO4+3KNO2+2H2O
本题解析:由K是一种红棕色气体,可知K是NO2,L是NO。由I是由第三周期元素组成的单质中熔点最高的金属,可知I是Al,又根据4FeS2+11O2 2Fe2O3+8SO2,可推得D是Fe2O3,A,是SO2, B是SO3, C是H2SO3。I和D发生铝热反应生成Fe和Al2O3,由纵观前面的反应,可推得G是Fe,H是Al2O3。则M的溶液为Fe(NO3)3溶液,M和C反应生成NO和Fe2(SO4)3,可得F是Fe2(SO4)3,E是Fe(OH)3。因此(1)题组成单质Fe的元素就位于第四周期Ⅷ族。(2)题反应⑦Fe和Al2O3发生铝热反应,氧化剂Al2O3与还原剂Fe的物质的量之比为1:2。(3)题②是SO2和O2反应生成SO3,是化合反应但同时也是氧化还原反应,③是SO3和水反应生成H2SO3既属于化合反应又属于非氧化还原反应,⑥是分解Fe(OH)3生成Fe2O3属于分解
2Fe2O3+8SO2,可推得D是Fe2O3,A,是SO2, B是SO3, C是H2SO3。I和D发生铝热反应生成Fe和Al2O3,由纵观前面的反应,可推得G是Fe,H是Al2O3。则M的溶液为Fe(NO3)3溶液,M和C反应生成NO和Fe2(SO4)3,可得F是Fe2(SO4)3,E是Fe(OH)3。因此(1)题组成单质Fe的元素就位于第四周期Ⅷ族。(2)题反应⑦Fe和Al2O3发生铝热反应,氧化剂Al2O3与还原剂Fe的物质的量之比为1:2。(3)题②是SO2和O2反应生成SO3,是化合反应但同时也是氧化还原反应,③是SO3和水反应生成H2SO3既属于化合反应又属于非氧化还原反应,⑥是分解Fe(OH)3生成Fe2O3属于分解
⑨是NO2和水的反应中不属于化合反应但属于非氧化还原反应。所以该题的答案是③。(4)题反应④的离子方程式是:3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O。(5)题,由题意得生成物中有K2FeO4,根据氧化还原反应得失电子守恒,可得该化学反应的化学反应方程式是:Fe2O3+3KNO3+4KOH =2K2FeO4+3KNO2+2H2O
点评:本题综合了氮和硫的氧化物和水合物的相关知识,但推断过程不是很复杂,需要学生记住一些常见的化学反应,掌握氧化还原反应方程式的配平和推导。
本题难度:困难
2、简答题 现有X.Y.Z三种常见短周期元素,x的原子结构示意图如图,Y、z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
(1)已知Y2?X2为浅黄色固体物质,其阴阳离子个数比为______,其中含有的化学键类型有______.
(2)将单质Z的薄片在酒精灯上加热至熔化,观察到的现象______,产生该现象的原因是______.
(3)Y、Z最高价氧化物对应的水化物混合反应生成盐和水的离子方程式为______.
(4)若(3)中生成物还可表示为YZ(OH)4,则YZ(OH)4与过量HC1溶液反应的离子方程式为______.
参考答案:X、Y、Z三种常见短周期元素,由于X的原子结构示意图可知a=2,故X为O元素,结合(1)Y2?X2为浅黄色固体物质,可知Y为Na元素,Y、Z为同周期金属元素,二者的最高价氧化物对应水化物可以反应生成盐和水,为氢氧化钠与氢氧化铝反应,故Z为Al元素,
(1)Na2O2由钠离子与过氧根离子构成的离子化合物,其阴阳离子个数比为1:2,过氧根离子与钠离子之间形成离子键,过氧根离子中氧原子之间形成非极性键,故答案为:1:2;离子键、非极性键;
(2)将单质Al的薄片在酒精灯上加热至熔化,由于反应生成氧化铝,氧化铝的熔点比铝高,氧化铝膜兜住铝箔融化成的小球不落下,故答案为:融化成的小球不落下;氧化铝的熔点比铝高;
(3)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)NaAl(OH)4与过量HC1溶液反应生成氯化铝、氯化钠与水,反应离子方程式为:Al(OH)4-+4H+=Al3++4H2O,故答案为:Al(OH)4-+4H+=Al3++4H2O.
本题解析:
本题难度:一般
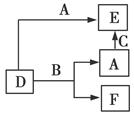
3、填空题 如图1,A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去).

请回答以下问题:
(1)写出原电池的负极反应方程式______.
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为______(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者______后者(用“>”、“<”或“=”表示).
(3)金属A的氯化物沸点较低,又易升华,能否电解这种熔融氯化物来生产A?______.原因是______.
(4)写出②的化学方程式______.
(5)写出A→J反应的化学方程式______.
(6)含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色.则:
①水溶液与NaHCO3溶液混合,反应的离子方程式为:______
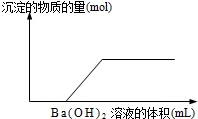
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图2:请回答:X晶体的俗名为______;其溶液的物质的量浓度为______mol/L.
参考答案:(1)题中H→A为工业冶炼金属铝,A→J为铝热反应,为推断题的突破口,依次可知C→E→H→A→J的转化是中学化学中常见反应,为AlO2-→Al(OH)3→Al2O3→Al→Fe之间的转化,该原电池是铝做负极,铁做正极,电解质溶液为NaOH,可以推知:A为Al,C为NaAlO,E为Al(OH)3,H为Al2O3,J为Fe,M为FeS,原电池中,Al做负极被氧化,在碱性溶液中生成AlO2-,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O;
(2)溶液C为NaAlO2,根据溶液呈电中性,即c(AlO2-)+c(OH-)=c(Na+)+c(H+)可知:c(Na+)-c(AlO2-)=c(OH-)-c(H+)=10-2-10-12?mol/L,故答案为:10-2-10-12?mol/L或c(OH-)-c(H+);?
(3)金属A的氯化物为AlCl3,为共价化合物在熔融状态下不导电,故答案为:否;因为A的氯化物熔沸点低,据此判断它的晶体为分子晶体,在熔融态时不电离,不能被电解;
(4)原电池正极生成H2,即D为H2,则G为氢化物,由G→I→K的转化可知该氢化物中存在变价非金属元素,应为N元素,故G为NH3,I为NO,K为NO2,L为HNO3,反应②为工业合成氨的重要反应,反应为:4NH3+5O2?催化剂.△?4NO+6H2O,
故答案为:4NH3+5O2?催化剂.△?4NO+6H2O?
(5)反应A→J为铝热反应,反应为:Fe2O3+2Al?高温?.?2Fe+Al2O3?故答案为:Fe2O3+2Al?高温?.?2Fe+Al2O3?
(6)①AlCl3水溶液与NaHCO3溶液反应相互促进的水解,反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,该反应为泡沫灭火器的反应原理,故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
?②含A元素的某盐X常做净水剂,X做焰色反应时,透过钴玻璃观察火焰呈紫色,说明盐中含有铝元素和钾元素,为明矾,俗称为明矾或白矾;
根据反应计算:
Ba2++SO42-═BaSO4
? 1mol? 233g
? n? 233g
则n=1mol,根据SO42-离子的守恒可知500mLKAl(SO4)2的溶液中含有溶质的物质的量为0.5mol,
故浓度为:0.5mol0.5L=1mol/L,故答案为:明矾或白矾;1mol/L.
本题解析:
本题难度:一般
4、选择题 A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是( )
A.D、E中一定都含有甲元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
参考答案:B
本题解析:A是甲的单质,根据图示,E中必含甲元素,B是乙元素单质,与D反应生成A,该反应是置换反应,所以D中必含甲元素,A项正确;B项,D是氧化物,与B单质反应,一般B是还原剂,错误;C项,A与C单质反应生成氧化物E,所以必有一种是氧气,正确;D项,若A是非金属,则D与B的反应一般是类似于水与钠间的置换,即D项正确。
点拨:本题考查元素化合物之间的转化与物质推断。难度中等。
本题难度:一般
5、选择题 向由盐酸、碳酸钠、硫酸、氯化铜、氯化钠中的一种或几种混溶形成的稀溶液中,滴入氢氧化钡溶液,产生沉淀的量与加入氢氧化钡溶液体积的关系如图所示,则下列关于该溶液中溶质的判断正确的是( )
A.可能含有氯化钠
B.肯定没有稀盐酸
C.肯定含有氯化铜
D.可能含有两种酸