微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为
A.0.1mol/L
B.0.15mol/L
C.0.2mol/L
D.0.25mol/L
参考答案:C
本题解析:分析:根据溶液呈电中性原则,溶液中应满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),以此解答该题.
解答:溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),
所以有3×0.4mol/L+c(K+)=2×0.7mol/L,
c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,
故选C.
点评:本题考查溶液浓度的计算,题目难度不大,注意从溶液电中性的角度计算溶液离子浓度.
本题难度:一般
2、选择题 如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法是(?)
A.过滤
B.分液
C.蒸发
D.蒸馏
参考答案:B
本题解析:对于不能互溶的两种液体,通常可以采取分液的方法来进行分离,所以正确答案是B。
本题难度:一般
3、选择题 有AgNO3、HCl、KSCN、NaOH四种溶液,只用一种试剂鉴别,这种试剂是( )
A.FeCl2溶液
B.Na2CO3溶液
C.氯水
D.FeCl3溶液
参考答案:D
本题解析:略
本题难度:一般
4、简答题 海带含有丰富的碘,为了从海带中提取碘,设计并进行以下实验:完成下列填空:
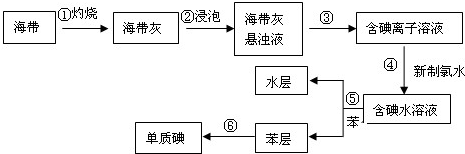
(1)步骤①灼烧海带时,不需要用到的仪器是______(选填编号)

(2)步骤③的操作名称是______;步骤⑤的操作名称是______.
(3)步骤④所发生反应的离子方程式是______.
(4)步骤⑤中不能用酒精代替苯的理由是______.
(5)检验提取碘后的水层是否还含有单质碘的方法是______.
参考答案:(1)灼烧海带的仪器是坩埚、用于加热的仪器是酒精灯、放置坩埚的仪器是泥三角,所以灼烧过程中不使用烧杯,故选c;
(2)分离固体和溶液的方法是过滤,根据溶解度的不同将碘水中的碘萃取到苯中,所以操作③的名称是过滤,⑤的操作名称是萃取,故答案为:过滤;萃取;
(3)氯气具有强氧化性,碘离子具有还原性,二者能发生氧化还原反应生成碘和氯离子,离子方程式为:2I-+Cl2=2Cl-+I2,故答案为:2I-+Cl2=2Cl-+I2;
(4)萃取剂的选取标准:萃取剂和原溶剂不能互溶,萃取剂和溶质及原溶剂不能反应,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,酒精和水互溶,所以酒精不能作萃取剂,故答案为:酒精与水互溶;
(5)碘遇淀粉试液变蓝色,要检验碘是否存在,其操作方法是:取样,滴入淀粉溶液,若溶液变为蓝色,则存在单质碘;若溶液不为蓝色,则不存在单质碘,
故答案为:取样,滴入淀粉溶液,若溶液变为蓝色,则存在单质碘;若溶液不为蓝色,则不存在单质碘.
本题解析:
本题难度:一般
5、填空题 废钒催化剂的主要成分是V2O5、VOSO4、K2SO4、SiO2和Fe2O3等,现欲利用以下工艺流程回收V2O5。
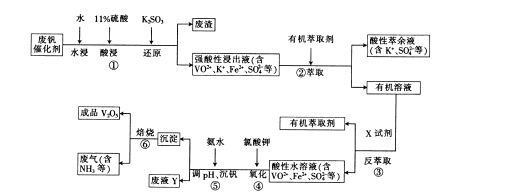
回答下列问题:
(1) VOSO4中,V元素的化合价为_______,①中产生的废渣的主要成分是_________。
(2)配平④中反应的离子方程式:
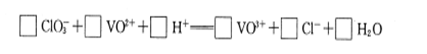
(3)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表:
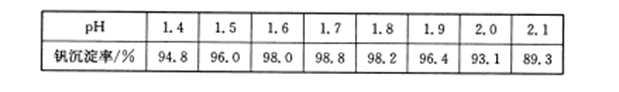
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为______________。
(4)生产时,将②中的酸性萃余液循环用于①中的水浸。在整个工艺流程中,可循环利用的物质还有________________。
(5)成品V2O5可通过铝热反应来制取金属钒,写出该反应的化学方程式:______________________________________。
参考答案:(1)+4;SiO2(2)1;6;6;6;1;3(3)1.7(4)有机萃取剂、氨水(或氨气)
(5)10Al+3V2O5 6V+5Al2O3
6V+5Al2O3
本题解析:(1)VOSO4中离子SO42-为-2价,O2-为-2价,根据化合价守恒,故V元素为+4价;废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,V2O5、Fe2O3和酸反应,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅(2)依据氧化还原反应元素化合价变化和电子守恒原子守恒分析配平,反应物中ClO3-中Cl元素是+5价,VO2+中V元素是+4价,产物中Cl-是-1价,VO3+是+5价,依据电子守恒、原子守恒配平得到离子方程式为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,故答案为:1;6;6;6;1;3(3)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.7,此时钒沉淀率达到最大(4)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,故答案为:有机萃取剂;氨气(5)铝热反应是金属铝在高温环境下对金属氧化物进行还原产生金属单质的反应,则反应物为V2O5和Al产物为Al2O3与V,根据反应中化合价守恒,故反应方程式:10Al+3V2O5 6V+5Al2O3
6V+5Al2O3
本题难度:困难