微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (10分)元素氯及其化合物在生产、生活、科研中有广泛的应用。
⑴25℃时,PbCl2固体在不同浓度盐酸(mol·L-1)中的
溶解度(mmol·L-1)如右图。
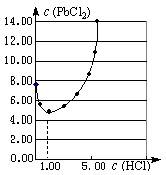
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用?。
a.蒸馏水? b.1mol·L-1盐酸
c.5 mol·L-1盐酸? d.10mol·L-1盐酸
②当盐酸的浓度小于1mol·L-1时,随着盐酸浓度的增大,? PbCl2的溶解度减小,其原因是?。
⑵TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为C3Cl3N3O3。
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为?。
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产物具有强氧化性,能够杀菌消毒。写出另一种产物的电子式?。
⑶高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射。目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵。写出由次氯酸电解制备高氯酸的阳极反应式:?。
参考答案:⑴①b?②Cl-浓度增大,PbCl2的溶解平衡逆向移动
⑵①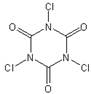 ?②
?②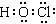
⑶①HClO+3H2O-6e-=ClO4—+7H+(每空2分,共10分)
本题解析:略
本题难度:一般
2、选择题 向KI溶液中加入AgNO3溶液,直到反应恰好完全为止,结果反应后溶液的质量恰好等于原KI溶液的质量,则该AgNO3溶液中溶质的质量分数为(? )
A.50.0%
B.48.8%
C.38.2%
D.72.3%
参考答案:D
本题解析:这是一道没有数据的计算题。根据题意可推知AgNO3溶液的质量等于生成AgI沉淀的质量。又AgNO3—AgI↓,则AgNO3溶液中溶质的质量分数为:
w(AgNO3)=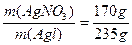 ×100%=72.3%。
×100%=72.3%。
本题难度:简单
3、选择题 将氯水滴入紫色石蕊试液、硝酸银溶液,将依次观察到紫色石蕊试液先变红后退色、有白色沉淀产生等现象。这些现象与氯水所含的下列哪种微粒无直接关系?
A.HClO
B.H2O
C.Cl—
D.H+
参考答案:B
本题解析:紫色石蕊试液遇酸性溶液显红色,所以先变红与H+有关;后褪色说明有强氧化性物质将红色物质漂白了,这与HclO有关;Cl—与Ag+结合生成白色AgCl沉淀。答案选B。
本题难度:简单
4、实验题 (11分)某中学高一化学兴趣小组的同学,在实验室探究用过量的锌与浓硫酸反应制取SO2。
①这样制取的SO2中可能含有的杂质有________。
②某同学用下列装置连接成一整套实验装置以验证①的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是______→______→______→______→______→(用a、b……填写;每套装置只允许使用一次)。
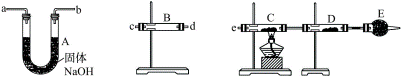
③根据②确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论填入下表:
装置
| 所盛药品
| 实验现象
| 结论
|
B
| ?
| ?
| ?
|
C
| CuO固体
| ?
| ?
|
D
| 无水CuSO4
| ?
|
?
参考答案:①H2、H2O(g) ②c→d→a→b→e→(c与d、a与b接口可对调)。
③
装置
所盛药品
实验现象
结论
B
无水CuSO4
白色粉末变成蓝色
气体中含有水蒸气
C
?
黑色固体变成红色
气体中含有氢气
D
?
白色粉末变成蓝色
本题解析:锌和浓硫酸反应时,随着反应的进行,浓硫酸的浓度逐渐减小,锌和稀硫酸反应产生H2,且反应是在溶液中进行的,必然会含有水蒸气。检验反应产物时,一般情况下先检验水蒸气后再检验其他产物。
本题难度:简单
5、选择题
A.NH3·H2O
B.BaCl2
C.NaOH
D.HCl
参考答案:A
本题解析:B、D中滴入AgNO3(aq)开始即生成白色沉淀,且沉淀不再溶解。C中滴入AgNO3(aq),生成白色AgOH沉淀,且AgOH沉淀不稳定,在溶液中发生分解反应生成Ag2O,所得暗棕色沉淀(AgOH和Ag2O的混合物)也不溶解。A中滴入少量AgNO3,发生以下反应:Ag++3NH3·H2O====[Ag(NH3)2]++NH4++OH-+2H2O,故无沉淀产生;继续滴入AgNO3(aq),至AgNO3过量时,总反应如下:Ag++NH3·H2O====AgOH↓+NH4+,故有沉淀产生。
本题难度:一般