微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)铝土矿的主要成分是Al2O3·3H2O,假设杂质是Fe2O3,写出由铝土矿制备金属铝的各步骤的化学方程式。(2013年高考题片段,源于高一教材)
(2)炼铁的原料有赤铁矿(假设杂质为SiO2)、焦炭、石灰石,设备为高炉,写出炼铁时所发生的主要的化学反应方程式?
(3)工业上用石英砂先煅烧制取粗硅,最后经过还原反应制取高纯硅,其反应方程式分别为:?
(4)假设没有Fe,生活会?
假设没有Al,生活会??
假设没有Si,生活会?
参考答案:(27分)方程式各2分,(4)问共3分
(1)①Al2O3+2NaOH=2NaAlO2+H2O?②NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
③2Al(OH)3 Al2O3+3H2O?④2Al2O3
Al2O3+3H2O?④2Al2O3 4Al+3 O2↑
4Al+3 O2↑
(2)①C+O2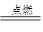 CO2?②CO2+C
CO2?②CO2+C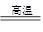 2CO?③Fe2O3+3CO
2CO?③Fe2O3+3CO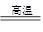 2Fe+3CO2
2Fe+3CO2
④CaCO3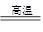 CaO+CO2↑?⑤CaO+SiO2
CaO+CO2↑?⑤CaO+SiO2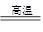 CaSiO3
CaSiO3
(3)①SiO2+2C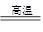 Si(粗硅)+2CO↑?②Si+2Cl2
Si(粗硅)+2CO↑?②Si+2Cl2 SiCl4
SiCl4
③SiCl4+2H2===Si(高纯硅)+4HCl
(4)合理答案都给分。没有Fe,过原始人的生活,没有Al,过封建社会生活,没有Si,没法过信息时代的生活。
本题解析:(1)铝土矿的主要成分是Al2O3·3H2O,杂质是Fe2O3,则提纯氧化铝时必须除去氧化铁。根据氧化铝两性氧化物可知,姜铝土矿溶解在氢氧化钠溶液中,氧化铝溶解,生成偏铝酸钠,过滤得到偏铝酸钠溶液。向偏铝酸钠中通入CO2即生成氢氧化铝沉淀,过滤即得到氢氧化铝。氢氧化铝分解生成氧化铝,电解氧化铝即得到金属铝。
(2)高炉炼铁时焦炭燃烧生成CO2,高温下碳和CO2反应又生成CO。生成的CO具有还原性,在高温下可以还原氧化铁。在高温下石灰石分解生成氧化钙和CO2,生成的氧化钙在高温下在和二氧化硅反应生成硅酸钙。
(3)石英砂的主要成分是二氧化硅,在高温下和二氧化硅反应生成粗硅。粗归和氯气在高温下反应生成四氯化硅,然后利用氢气还原四氯化硅置换出单质硅。
点评:该题是基础性试题的考查,试题基础性强,紧扣教材基础知识,有利于调动学生的学习兴趣,激发学生的学习积极性。也有利于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般
2、选择题 化学与生产、生活、社会密切相关。下列有关说法中,错误的是
A.今夏,湖北地区出现了严重的旱情,缓解旱情的措施之一是用碘化银进行人工增雨
B.新能源汽车的推广与使用有助于减少光化学烟雾的产生
C.利用太阳能、风能和氢能等能源替代化石能源有利于实现“低碳经济”
D.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的单质硅
参考答案:A
本题解析:A项云中的水汽胶性状态比较稳定,不易产生降水,而人工增雨就是要破坏这种胶性稳定状态。在云雾厚度比较大的中低云系中播散催化剂(碘化银)可增加云中的凝结核数量,有利水汽粒子的碰并增大,形成降雨;
B项化石燃料燃烧后的汽车尾气是光化学烟雾的罪魁祸首,使用新能源是减少光化学烟雾的有效途径
C项,太阳能、风能和氢能都属于清洁型能源,不污染环境
D项,光纤的主要成分是二氧化硅
点评:此类题主要考察化学知识在生产生活中的运用,考查物质的性质、用途等。平时多加留意积累即可。难度较小
本题难度:简单
3、选择题 利用金属活性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是(?)
A.2Al2O3(熔融)  4Al+3O2↑
4Al+3O2↑
B.Fe2O3+3CO 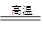 2Fe+3CO2
2Fe+3CO2
C.Fe+CuSO4 ===FeSO4+Cu
D.2NaCl(水溶液) 2Na+Cl2↑
2Na+Cl2↑
参考答案:D
本题解析:金属的冶炼一般依据金属性强弱选择,活泼的金属采用电解法,不活泼的金属采用热分解,处于中间的金属,采用还原剂还原,所以ABC都是正确的,D不正确,钠属于活泼的金属,应该用电解法,答案选D。
本题难度:一般
4、填空题 工业上用白云石制备高纯氧化镁的工艺流程如下:
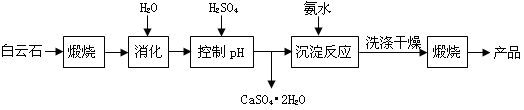
已知白云石的主要成分可表示为:
CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%
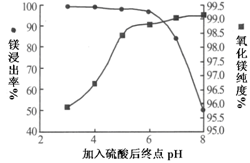
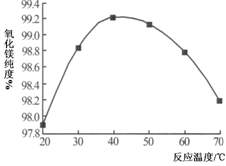
(1)为了提高白云石的煅烧效果,可以采取的措施是?。
若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要?。
A.蒸发皿
B.坩埚
C.泥三角
D.石棉网