|
高考化学知识点归纳《反应速率与平衡的有关计算》高频考点巩固(2017年模拟版)(十)
2017-08-08 06:24:49
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫元素的化合物在生产、生活中有着广泛的应用。
(1)400℃,1.01× ?Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3 molO2 (g),发生 ?Pa下,容积为1.0L的密闭容器中充入0.5molSO2,(g)和0.3 molO2 (g),发生 反应中n(SO3)和n(O2)随时间变化的关系如图所示。反应的平衡常数K=_______;0到10 min内用SO2:表示的平均反应速率_________。更具图中信息,判断下列叙述中正确的是_____(填序号)。 反应中n(SO3)和n(O2)随时间变化的关系如图所示。反应的平衡常数K=_______;0到10 min内用SO2:表示的平均反应速率_________。更具图中信息,判断下列叙述中正确的是_____(填序号)。

A.a点时刻的正反应速率比b点时刻的大
B.c点时刻反应达到平衡状态
C.d点和e点时刻的c(O2)相同
D.若5 00℃,1.01× Pa下,反应达到平衡时,n( SO3)比图中e点时刻的值大 Pa下,反应达到平衡时,n( SO3)比图中e点时刻的值大
| (2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,25℃时测得溶液的pH=5.6,溶液中Na+,H+, HSO- 3,SO2- 3离子的浓度由大到小的顺序是__________________
(3)可通过电解法使(2)中的吸收液再生而循环利用(电极均为石墨电极),其工作示意图如下:
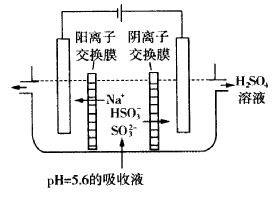
HSO- 3在阳极室反应的电极反应式为_______________________________.
阴极室的产物_________________。
参考答案:(12分)
(1)160 (mol·L-1)-1(2分); 0.04 mol·L-1·min-1(2分);AC(2分)
(2)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)(2分)
(3)HSO- 3+H2O=SO2- 4+3H++2e- (2分)? H2、NaOH(2分)
本题解析:
(1)在10min时建立平衡:2SO2?+? O2? ?2SO3 ?2SO3
始态0.5mol ?0.3 mol? 0mol
变化量0.4mol ?0.2mol? 0.4mol
终态0.1mol ?0.1 mol? 0.4mol
平衡常数K=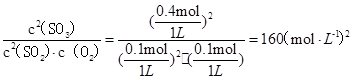 ;SO2的平均反应速率=0.4mol/(1L×10min)=" 0.04" mol·L-1·min-1;A.a点反应正向进行,反应物在减少,所以a点时刻的正反应速率比b点时刻的大,正确;B.在10min时建立平衡,各物质的量不在改变,错误;C.d点和e点是相同的平衡状态,所以d点和e点时刻的c(O2)相同,正确; D.放热反应,温度越高,平衡逆向移动n( SO3)碱小,错误 ;SO2的平均反应速率=0.4mol/(1L×10min)=" 0.04" mol·L-1·min-1;A.a点反应正向进行,反应物在减少,所以a点时刻的正反应速率比b点时刻的大,正确;B.在10min时建立平衡,各物质的量不在改变,错误;C.d点和e点是相同的平衡状态,所以d点和e点时刻的c(O2)相同,正确; D.放热反应,温度越高,平衡逆向移动n( SO3)碱小,错误
(2)用NaOH溶液吸收工业废气中的SO2,当吸收液失去吸收能力时,,溶质应为亚硫酸氢钠。HSO- 3的电离程度大于水解程度,所以c(Na+)> c(HSO- 3)> c(H+)> c(SO2-3)> c(OH-)。
(3)HSO- 3在阳极室反应的电极反应式HSO- 3+H2O=SO2- 4+3H++2e-;阳极室氢离子放电,产物为H2、NaOH。
本题难度:困难
2、选择题 在体积恒定的密闭容器中,一定量的SO2与1mol O2在催化剂作用下加热到600℃发生反应:
2SO2+O2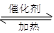 2SO3?△H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是 2SO3?△H<0。当气体的物质的量减少0.5mol时反应达到平衡。下列叙述正确的是
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,会得到两种白色沉淀
D.该反应过程中转移了2mol电子
参考答案:D
本题解析:结合方程式,当气体的物质的量减少0.5mol时消耗氧气0.5mol,转移的电子数为2mol,达平衡时将混合气体通入BaCl2溶液中,会生成BaSO4,降低温度时,正反应速率减小程度小于逆反应速率的减小程度,A项SO3的生成速率与SO2的消耗速率的方向相同,不能确定是否平衡。
本题难度:一般
3、选择题 在一密闭恒容容器中发生如下反应:aX(g)+bY(g)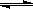 cZ(g)?ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是 cZ(g)?ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
A.升高温度,正反应速率增大,逆反应速率减小, 平衡常数增大
B.若通入稀有气体平衡不移动,则a+b=c
C.若加入催化剂,反应速率改变,但平衡不移动
D.若增加X的量,平衡正向移动,X的转化率增大
参考答案:C
本题解析:A、升高温度正逆反应速率同时增大,错误;B、定温定容的条件下充“惰气”对化学平衡无影响,相当于什么也没做,不能据此判断a、b、c的关系,错误;C、正确;D、增加一种反应物的浓度可以提高另一反应物的转化率,而其自身的转化率降低,错误。
本题难度:一般
4、填空题 (14分)下图是几种有机物的转换关系,请按要求填空:
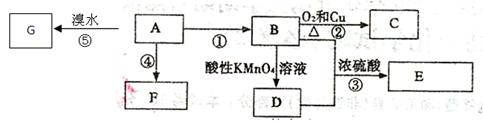
已知:A是来自石油的重要有机化工原料,对水果有催熟作用;75%的B可用于医用消毒;E是具有果香味的有机物;F是一种高聚物,可制成多种包装材料。
(1)A的分子式为?,A和酸性高锰酸钾溶液作用的现象是:?。
(2)C的名称?,F的结构简式为?。
(3)D分子中的官能团名称是?,请设计一种实验来验证D物质存在该官能团的方法是?
?。
(4)请写出反应⑤的方程式:?。
(5)请填写反应类型:A生成F?;
(6)下列关于A和F的叙述正确的是?。
A.A常温下是气体,为纯净物;F常温下是固体,为混合物
B.A与F的化学性质完全相同
C.取等质量的A和F完全燃烧后,生成的CO2和H2O的质量分别相等
D.取等物质的量的A和F完全燃烧后,生成的CO2和H2O的物质的量分别相等
参考答案:(1) C2H4,?高锰酸钾溶液褪色?(1+1分)
(2)乙醛,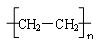 ?(1+2分) ?(1+2分)
(3)羧基(1分)?取少量的物质于试管中滴加石蕊试液,若溶液变红则证明该物质中存在—COOH(可以用Na2CO3溶液、Mg、新制Cu(OH)2等)(2分)
(4)CH2=CH2 + Br2 → CH2Br-CH2Br?(2分)
(5)加聚(2分)?(6)AC?(2分)
本题解析:A是来自石油的重要有机化工原料,对水果有催熟作用,因此A是乙烯。75%的B可用于医用消毒,则B是乙醇。乙烯中含有碳碳双键,能和吸收发生加成反应生成G,即G是CH2.BrCH2Br。乙烯也能发生加聚反应生成高分子化合物聚乙烯,即F是聚乙烯。乙烯和水发生加成反应即生成乙醇,乙醇中含有羟基,能发生催化氧化生成乙醛。乙醇也可以在强氧化剂的作用下直接被氧化生成乙酸,则D是乙酸,乙酸和乙醇可以发生酯化反应生成乙酸乙酯,即E是乙酸乙酯。
本题难度:一般
5、选择题 下列叙述正确的是? (?)
A.恒容密闭容器中进行的反应3A(g)  B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大 B(g)+c(g),在其他条件不变的情况下,再充入一定量的A气体,A的转化率将增大
B.对于可逆反应N2(g)+3H2(g)  2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加 2NH3(g),增大氮气浓度可增加活化分子百分数,从而使反应速率增加
C.将A1C13溶液和NaAlO2溶液分别蒸干后灼烧,所得固体产物均为A1203
D.反应NH3(g)+HCl(g)  NH4C1(s) ΔH<O在任何条件下均能自发进行 NH4C1(s) ΔH<O在任何条件下均能自发进行
参考答案:A
本题解析:A、该反应正反应方向气体的系数减小,在其他条件不变的情况下,再充入一定量的A气体,容器内压强增大,平衡向右移动, A的转化率将增大,正确;B、增大氮气浓度可增加活化分子的数目,但不能增加活化分子百分数,错误;C、将A1C13溶液蒸干后灼烧,所得固体产物为Al2O3,错误;D、反应NH3(g)+HCl(g)  NH4C1(s)? ΔH<O,?S < 0,?H—T?S高温时可能> 0,不能自发进行,错误。 NH4C1(s)? ΔH<O,?S < 0,?H—T?S高温时可能> 0,不能自发进行,错误。
本题难度:一般
| 