微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式的书写正确的是
A.实验室用浓盐酸与MnO2反应制Cl2:
MnO2 +4HCl(浓) Cl2↑+Mn2+ +2Cl-+2H2O
Cl2↑+Mn2+ +2Cl-+2H2O
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH—+H++ SO42—+ NH4+ =BaSO4↓+ NH3·H2O +H2O
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:
Ca2++ HCO3—+OH—=CaCO3↓+H2O
D.铜溶于稀硝酸:3Cu + 8H+ + 2NO3-= 3Cu2+ + 2 NO↑+ 4H2O
参考答案:BD
本题解析:A项,HCl(浓)必须拆成离子形式;C项,根据“少定多变法”,正确的为Ca2++2 HCO3—+2OH—=CaCO3↓+H2O+CO32-.
本题难度:简单
2、选择题 下列反应的离子方程式书写正确的是
[? ]
A.标准状况下2.24L CO2通入1mol/L 100mL NaOH溶液中:CO2+OH-=HCO3-
B.氢氧化亚铁在空气中被氧化:4Fe2+ + O2 + 2H2O = 4Fe3+ + 4OH-
C.硫化钠水解:S2-+2H2O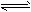 H2S+2OH-
H2S+2OH-
D.等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH- = CO32- + NH3↑+2H2O
参考答案:A
本题解析:
本题难度:一般
3、选择题 下列离子方程式, 正确的是?(?)
A.氯化铝溶液与过量氨水 Al3++3NH3·H2O →Al(OH)3↓+3NH4+
B.明矾净水原理:Al3++3H2O →Al(OH)3↓+3H+
C.将足量氯气通入溴化亚铁溶液:2Fe2++Cl2→2Fe3++2Cl-
D.偏铝酸钠溶液与过量盐酸AlO2-+H++H2O →Al(OH)3↓
参考答案:A
本题解析:略
本题难度:简单
4、选择题 下列离子方程式正确的是 (?)
A.碳酸钙和盐酸反应: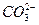 +2H+====H2O+CO2↑
+2H+====H2O+CO2↑
B.向氢氧化钡溶液中加硫酸溶液:Ba2++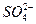 ====BaSO4↓
====BaSO4↓
C.向氯化铜溶液中加铁粉:Cu2++Fe====Cu+Fe2+

D.向稀盐酸溶液中加铁:2Fe+6H+====2Fe3++3H2↑
参考答案:C
本题解析:略
本题难度:一般
5、简答题 已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:
(1)A的元素符号为______,C的氢化物的化学式为______.
(2)为比较C与D的单质的氧化性强弱,可设计实验以证实,则该实验所依据的反应的化学方程式为______.
(3)1molC的氢化物与足量C的氧化物反应,转移的电子的物质的量为______mol.
(4)已知E、G、F是均含有B元素的化合物,其有关转化关系如图,请写出E与F反应生成G的离子方程式______.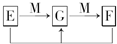
参考答案:(1)A原子的最外层与次外层电子数相等可知A为Be.A与D最外层电子数之和为9,可知D最外层7个电子,且分别属于不同的主族,D为Cl.和为9,且A、B、C、D中只有两种金属元素,可知B最外层3个电子,B为Al.C为S.C的氢化物的化学式为H2S.
(2)氧化性:Cl2>S,根据氧化性:氧化剂>氧化产物,则有H2S+Cl2═S↓+2HCl.
当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性强弱.如:Fe+S?△?.?FeS,2Fe+3Cl2?△?.?2FeCl3
(3)SO2+2H2S=3S↓+2H2O,1mol二氧化硫得到4mol电子,1mol硫化氢失2mol电子.
(4)B为Al,常见存在形式为AlO2-,Al(OH)3,Al3+,
故答案为:(1)Be H2S
(2)Fe+S?△?.?FeS,2Fe+3Cl2?△?.?2FeCl3(或H2S+Cl2═S↓+2HCl)
(3)2
(4)Al3++3AlO2-+6H2O═4Al(OH)3
本题解析:
本题难度:一般