微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 在一密闭容器中,反应2SO2(g)+O2(g)═2SO3(g)+Q(Q>0)达到平衡.完成下列填空:
(1)升高温度,平衡向______方向移动(选填“正反应”或“逆反应”).在工业生产中反应温度控制在400~500℃,主要是因为______.
(2)欲使SO2转化率增大,可采取的措施有______、______.
(3)若容器容积为2L,开始加入的SO2为0.1mol,20s后测得SO3的物质的量为0.08mol,则O2的平均反应速率为______mol/(L?s).
参考答案:(1)该反应为放热反应,则升高温度,平衡向逆反应方向移动;生产中反应温度控制在400~500℃,是因该温度下催化剂活性最大,
故答案为:逆反应;
(2)欲使SO2转化率增大,可使平衡正向移动,采取措施为加压、通入氧气等,故答案为:加压;通入氧气;
(3)20s后测得SO3的物质的量为0.08mol,则v(SO3)=0.08mol2L20s=0.002mol/(L?s),由反应速率之比等于化学计量数之比可知,v(O2)=12×v(SO3)=12×0.002mol/(L?s)=0.001mol/(L?s),故答案为:0.001.
本题解析:
本题难度:一般
2、填空题 一定条件下,在体积为3L的密闭容器中化学反应 CO(g)+2H2(g)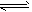 CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。

(1)该反应的平衡常数表示K=______________根据上图降低温度K将__________(填“增大”、
“减小”、“不变”)
(2)500℃时,从反应开始到达到平衡状态,以CO的浓度变化表示的化学反应速率是v(CO)=__________
(用nB、tB表示)
(3)判断可逆反应达到平衡状态的标志是_________________(填字母)
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.容器内气体的压强保持不变
d.CO、H2、CH3OH的浓度不再改变
(4)300℃时,讲容器的体积增大1倍,在其他条件不变的情况下,对平衡体系产生的影响是_________
(填字母)
a.c(H2)增大
b.正反应速率减慢,逆反应速率加快
c.CH3OH的物质的量减少
d.重新平衡时c(H2)/c(CH3OH)增大
参考答案:(1)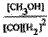 ;增大
;增大
(2)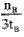 mol·L-1·min-1
mol·L-1·min-1
(3)cd
(4)cd
本题解析:
本题难度:一般
3、填空题 硫酸工业中存在如下反应:2SO2(g)+O2(g)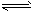 2SO3(g) △H<0
2SO3(g) △H<0
(1)写出该反应的平衡常数表达式_______,升高温度平衡常数_______(填“不变”、“增大”、“减小”)。
(2)该反应达平衡后,若只增大压强,平衡将向_______方向移动;若只升高温度,平衡向_______方向移动。
(3)实际生产中要用过量的空气,原因是______________;还需加入催化剂,目的是______________;不在高温下进行该反应的理由是______________。
参考答案:(1)K=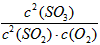 ;减小
;减小
(2)正反应;逆反应
(3)增大来源丰富、成本低的反应物浓度,提高SO3产量;加快反应速率;该反应为放热反应,温度太高尽管反应速率快,但产量低
本题解析:
本题难度:一般
4、选择题 下列事实中,不能用勒夏特列原理解释的是( )
A.新制氯水在光照下溶液颜色变浅
B.应CO+NO2?CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动
C.2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
参考答案:A、对氯水中的次氯酸受光照射会分解,次氯酸浓度减小,使得化学平衡Cl2+H2O?HCl+HClO向右移动,能用勒夏特列原理解释,故A错误;
B、该反应是放热反应,升高温度,平衡向逆反应方向移动,能用勒夏特列原理解释,故B错误;
C、该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,故C正确;
D、合成氨的正反应是放热反应,降低温度平衡向逆反应方向移动,为提高NH3的产率,理论上应采取低温度的措施,所以能用勒夏特列原理解释,故D错误;
故选C.
本题解析:
本题难度:一般
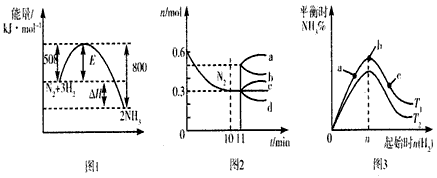
5、选择题 合成氨反应为N2(g) +3H2(g) 2NH3(g)。图1表示在一定温度下反应过程中的能量变化,图2表示在2L密闭容器中反应时N2的物质的量随时间变化的曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。
2NH3(g)。图1表示在一定温度下反应过程中的能量变化,图2表示在2L密闭容器中反应时N2的物质的量随时间变化的曲线,图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。
下列说法正确的是
[? ]
A.该反应为自发反应,由图1可知加入适当的催化剂,E和△H都减小
B.图2中,0~10min内该反应的平均速率v(H2)=0. 045 mol·L-1·min-1,从11 min起,其他条件不变,压缩容器的体积,使其为1L,则n(N2)的变化曲线为d
C.图3中,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D.图3中,T1和T2表示温度,对应温度下的平衡常数为K1和K2,则:T1>T2,K1>K2
参考答案:B
本题解析:
本题难度:一般