微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列过程中,不涉及氧化还原反应的是
A.浓硫酸加入蔗糖固体中
B.金属钠放置在空气中变质
C.SO2使品红溶液褪色
D.NO2形成酸雨
参考答案:C
本题解析:A.浓硫酸加入蔗糖固体中使蔗糖碳化变黑,发生了氧化还原反应
B.金属钠放置在空气中变质最终生成了碳酸钠粉末,发生了氧化还原反应
C.SO2使品红溶液褪色体现了SO2的漂白性,是化合性漂白,没发生氧化还原反应
D.NO2形成酸雨是NO2与水反应生成硝酸和NO,化合价有变化,发生了氧化还原反应
本题难度:简单
2、填空题 向500mL?NaOH溶液中投入10.8g?Al,二者恰好完全反应,试回答:
(1)Al和NaOH溶液反应的化学方程式为______,
(2)NaOH的物质的量浓度为______,
(3)标准状况下生成H2的体积为______.
参考答案:(1)铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)令10.8gAl完全反应需要NaOH的物质的量为nmol,则:
?2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g? 2mol
10.8g? nmol
所以54g:10.8g=2mol:nmol
解得:n=0.4mol
所以氢氧化钠溶液的浓度为0.4mol0.5L=0.8mol/L;
故答案为:0.8mol/L;
(3)令10.8gAl完全反应生成氢气的物质的量为amol,则:
?2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g? 3mol
10.8g? amol
所以54g:10.8g=2mol:amol
解得:n=0.6mol
所以生成氢气的体积为:0.6mol×22.4L/mol=13.44L
故答案为:13.44L.
本题解析:
本题难度:一般
3、选择题 下列叙述中不正确的是(? )
?
A.电解质是指在熔融状态和水溶液中均能导电的化合物
B.同温同压下,任何不同气体分子的间距均几乎相同
C.复分解反应一定不是氧化还原反应
D.1molAl与盐酸或氢氧化钠溶液完全反应时,失去电子数目均为3NA
参考答案:A
本题解析:溶于水或在熔融状态下能够导电的化合物是电解质,A不正确,其余选项都是正确的。
点评:在理解电解质或非电解质时,不能只依据能否导电这一实验现象。因为溶液导电的原因是溶液中有自由移动的阴阳离子,而电解质能够提供这样的阴阳离子,例如SO2不能电离出阴阳离子,所以是非电解质,而SO2溶于水生成的亚硫酸能够电离出阴阳离子,因此亚硫酸是电解质。
本题难度:一般
4、实验题 (14分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
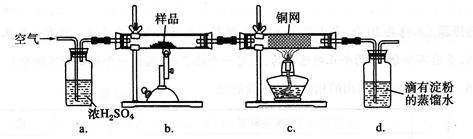

现称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe2O3、FeO和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05000 mol·L-1标准碘溶液进行滴定,初读数为0.10 mL,末读数如右图所示。
(1)冶炼铜的反应为8CuFeS2+ 21O2 高温8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)装置a的作用是 。
A.有利于空气中氧气充分反应
B.除去空气中的水蒸气
C.有利于气体混合
D.有利于观察空气流速