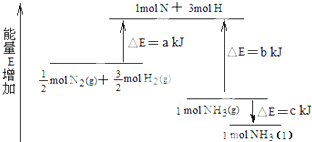|
|
|
高考化学知识点整理《热化学方程式》试题巩固(2017年最新版)(十)
2017-08-08 06:43:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 心脏起搏器电源—锂碘电池的电池反应为:2 Li(s) + I2 (s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ΔH2 则下列说法正确的是( )
A.ΔH=1/2ΔH1 -ΔH2
B.ΔH=1/2ΔH1 +ΔH2
C.ΔH=1/2ΔH1 -1/2ΔH2
D.ΔH=1/2ΔH1 +1/2ΔH2
|
参考答案:C
本题解析:锂碘电池的电池反应方程式可以由已知方程式(①-②)÷2得到,所以ΔH=1/2ΔH1 -1/2ΔH2 ,故选C。
考点:本题考查的是盖斯定律的应用计算。
本题难度:一般
2、填空题 (4分)丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)写出表示丙烷气体燃烧热的热化学方程式
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)  CO2(g) + H2(g) △H1=" +" 41.2kJ/mol CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则υ(H2)= ,此过程吸收的热量为_____________。
(3)对于反应CO(g) + H2O(g)  CO2(g) + H2(g) △H1=" +" 41.2kJ/mol CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥υ(CO2)正=υ(H2O)逆
参考答案:(1)C3H8(g)+ 5O2(g) ="=" 3 CO2(g) + 4 H2O(l) △H=-2219.9kJ/mol
(2) 0.16mol/(L·min) 32.96kJ
(3) ①④⑤⑥
本题解析:(1)燃烧热强调可燃物为1mol。(①+②×3)÷2得:
C3H8(g)+ 5O2(g) ="=" 3 CO2(g) + 4 H2O(l) △H=-2219.9kJ/mol
(2)υ(H2)= 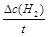 =0.16 mol/(L·min),吸收的热量为41.2×0.8kJ=32.96kJ。 =0.16 mol/(L·min),吸收的热量为41.2×0.8kJ=32.96kJ。
(3)反应前后化学计量数不变,压强不发生变化说明体系温度不发生变化,反应达到平衡状态,①、⑤正确;气体的质量和体积保持不变,所以无论是平衡态还是非平衡态,气体的密度均不变,②错误;气体的质量不变,物质的量不变,所以气体的平均相对分子质量保持不变,③错误;各组分浓度保持不变,说明反应达到平衡状态,④正确;υ(CO2)正=υ(H2O)逆说明正逆反应速率相等,⑥正确。
考点:盖斯定律 燃烧热 化学反应速率 化学平衡状态标志
点评:化学平衡状态的标志是各组分浓度不变、正逆反应速率相等,此外还有其它标志,如体系温度不再发生变化、体系颜色不再发生变化等。
本题难度:困难
3、简答题 (1)已知4g甲烷气体充分燃烧生成CO2(g)和H2O(l)时,放出Q?kJ的热量.甲烷燃烧的热化学方程式为______.
(2)我国自行研制的优质磷酸二氢钾(KDP)晶体被应用于大功率固体激光器中.反应方程式为H3PO4(aq)+KCl(aq)

?KH2PO4(aq)+HCl(aq),当反应时间不同时,产品产率和产品中Cl?含量变化情况如图所示.KDP晶体的一级品标准:Cl-质量分数低于0.2%.
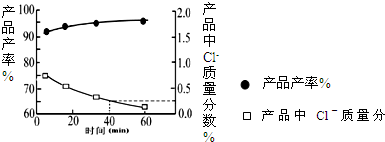
由图中可知,当反应进行到约______min时,KDP晶体达到一级品标准,此时的产品产率约为______.
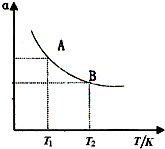
(3)如图在一定条件下,将1mol?N2与3mol?H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,试回答:
①N2的转化率αA为______;
②在状态A时,平衡常数KA=______(代入数值即可)当温度由T1变到T2时,KA______KB(填“>”、“<”或“=”);
(4)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c______>c______>c______>c______
②当盐酸与氨水等物质的量反应时,溶液的pH______7(填“>”或“<”或“=”,下同)
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3?H2O)______n(HCl),溶液中c(?NH4+)______c(Cl-).
参考答案:(1)4g甲烷的物质的量为4g16g/mol=0.25mol,放出QkJ的热量,
则1molCH4反应放热为4QkJ,则热化学方程式为CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4Q?kJ?mol-1,
故答案为:CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-4Q?kJ?mol-1;
(2)因KDP晶体的一级品标准:Cl-质量分数低于0.2%,黑球表示产品产率,方框表示氯离子的质量分数,
由图象可以看出,60min时Cl-质量分数低于0.2%,则为一级品,且产品产率为95%,故答案为:60;95%;
(3)1mol?N2与3mol?H2混合于一个10L密闭容器中,反应达到A平衡时,混合气体中氨体积分数为25%,
设转化的氮气的物质的量为x,则
? ?N2+3H2催化剂
本题解析:
本题难度:一般
4、选择题 已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中l mol O=O键完全断裂时吸收热量496 kJ,水蒸气中l mol H-O键形成时放出热量463 kJ.则氢气中l mol H-H键断裂时吸收热量为 ( )
A.920 kJ
B.557 kJ
C.436 kJ
D.188 kJ
|
参考答案:C
本题解析:反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以有2×x+496 kJ/mol-2×2×463 kJ/mol=-121 kJ/mol×4,解得x=436 kJ/mol,答案选C。
本题难度:一般
5、选择题 化学反应N2+3H2=2NH3的能量变化图所示,该反应的热化学方程式是( ? )
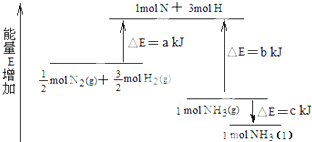
A.N2(g)+3H2(g)?2NH3(l)△H=2(a-b+c)?kJ/mol
B.N2(g)+3H2(g)?2NH3(l)△H=2(a-b-c)?kJ/mol
C.1/2N2(g)+3/2H2(g)?NH3(l)△H=(b+c-a)?kJ/mol
D.1/2N2(g)+3/2H2(g)?NH3(g)△H=(a+b)?kJ/mol
参考答案:B
本题解析:
本题难度:一般