微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
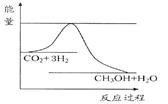
(1)关于该反应的下列说法中,其△H 0。(填“大于”、“小于”或“等于”), 且在 (填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为 。
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)若为两个容积相同的密闭容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1mol CH3OH(g)和1 mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) (填“大于”“小于”或“等于”)乙容器内n(CH3OH)。
(5)已知:CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,写出CH3OH燃烧生成CO2和水蒸气的热化学方程式______________________________________。
(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。
①负极的电极反应式为 。
②若以石墨为电极,电解硫酸铜溶液,写出电解的总反应方程式 。若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,当消耗1.6甲醇时,在阴极会析出 g铜。
参考答案:(1)小于 较低 (2)K=c(CH3OH)·c(H2O)/[c(CO2)·c3(H2)]
(3)增大 (2分) (4)等于(2分)
(5)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1302kJ/mol(2分)
(6)①CH3OH+8OH- - 6e-=CO32- + 6H2O,② 2Cu2++2H2O=Cu+O2↑+4H+, 9.6
本题解析:(1)根据该反应的能量关系图知,反应物的总能量大于生成物的总能量,该反应为放热反应,△H小于0;该反应正向为气体物质的量减小的放热反应,ΔH<0,ΔS<0;根据化学反应方向的判据ΔH —TΔS,若该反应自发进行,则有ΔH —TΔS<0,在较低温度下有利于该反应自发进行;(2)根据题给反应方程式知,该反应平衡常数K的表达式为K=c(CH3OH)·c(H2O)/[c(CO2)·c3(H2)];(3)该反应为放热反应,温度降低,平衡正向移动,平衡常数K增大;(4)根据等效平衡知识知,在一定条件下的可逆反应,无论反应从正向开始,还是从逆向开始,只要最初加入的物质的量相当,就会达到同一平衡状态,则达到平衡时,甲容器内n(CH3OH)等于乙容器内n(CH3OH);(5)已知:①CO(g)+2H2(g) = CH3OH (g) △H=" -116" kJ?mol-1;②CO(g)+1/2O2(g)=CO2(g) △H="-283" kJ?mol-1;③H2 (g)+1/2O2(g)=H2O(g) △H="-242" kJ?mol-1 ,根据盖斯定律知,②×2+③×4—①×2,得CH3OH燃烧生成CO2和水蒸气的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH="-1302kJ/mol" ;(6)以甲醇和氧气为燃料,氢氧化钾溶液为电解质溶液构成电池。①原电池负极发生氧化反应,甲醇在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OH+8OH- - 6e- =CO32- + 6H2O,②若以石墨为电极,电解硫酸铜溶液,电解的总反应方程式2Cu2++2H2O=2Cu+O2↑+4H+,若以此燃料电池电解200 mL 0.8mol/L的硫酸铜溶液,1.6g甲醇的物质的量为0.05mol,根据电极反应式知,转移的电子为0.3mol,根据电子守恒知,在阴极会析出铜0.15mol,质量为9.6g。
考点:考查化学反应与能量变化、盖斯定律、燃料电池和电化学计算。
本题难度:困难
2、选择题 通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。则下列热化学方程式不正确的是

[? ]
A.1/2H2(g)+1/2Cl2(g)==HCl(g) △H = -91. 5kJ·mol-1
B.H2(g) +Cl2(g)==2HCl(g) △H = -183kJ·mol-1
C.1/2H2(g)+1/2Cl2(g)==HCl(g) △H =+91. 5kJ·mol-1
D.2HCl(g)==H2(g)+Cl2(g) △H =+183kJ·mol-1
参考答案:C
本题解析:
本题难度:一般
3、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
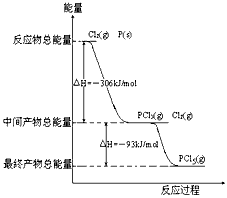
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________
(3)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______
△H3(填“大于”、“小于”或“等于”)
参考答案:(1)P(s)+Cl2(g)==PCl3(g);△H=-306kJ·mol-1
(2)PCl5(g)==PCl3(g)+Cl2(g);△H=+93kJ·mol-1
(3)-399kJ·mol-1;等于
本题解析:
本题难度:一般
4、填空题 (5分)(1)已知1 g丙烷完全燃烧生成气态水,放出的热量是47 kJ,又知:
H2O(l)== H2O(g) ΔH=+ 44 kJ·mol-1,则表示丙烷燃烧热的热化学方程式为
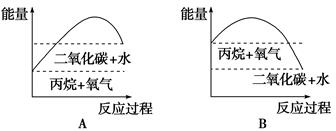
(2)下图中能较准确地反映丙烷燃烧时能量变化的曲线是________。
(3)已知在298K时下列反应的反应热为:
①CH3COOH(l) + 2O2(g)=2CO2(g)+2H2O (l)△H1=-870.3KJ/mol
②C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol
③H2(g)+1/2O2(g)=H2O (l) △H3=-285.8KJ/mol
则反应:2C(s) +2H2(g) +O2(g)=CH3COOH(l)的反应热
△H= KJ/mol
参考答案:(1)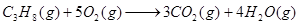 △H=-2224kJ/mol
△H=-2224kJ/mol
(2)B (3)-488.3
本题解析:(1)燃烧热是指在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。根据题意可知,1mol丙烷完全燃烧生成4mol气态水,放出的热量是47kJ×44=2068kJ。而4mol气态水变成液态水又放出44kJ×4=176kJ,所以丙烷的燃烧热是(2068+176)kJ/mol=2224kJ/mol,因此热化学方程式为
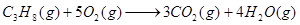 △H=-2224kJ/mol
△H=-2224kJ/mol
(2)因为是放热反应,所以反应物的总能量高于生成物的总能量,因此答案选B。
(3)考查盖斯定律的应用,根据已知反应可知②×2+③×2-①即得到2C(s) +2H2(g) +O2(g)=CH3COOH(l),所以反应热是-393.5KJ/mol×2-285.8KJ/mol×2+870.3KJ/mol=--488.3kJ/mol。
本题难度:一般
5、选择题 沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成CO2和H2O(l),放出445 kJ热量,则下列热化学方程式中正确的是
[? ]
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH == +890 kJ·mol-1
B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH == +890 kJ·mol-1
C.CH4(g) + 2O2(g) == CO2(g) + 2H2O(l) ΔH == -890 kJ·mol-1
D. CH4(g) + O2(g) ==
CH4(g) + O2(g) == 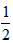 CO2(g) +H2O(l) ΔH == -890 kJ·mol-1
CO2(g) +H2O(l) ΔH == -890 kJ·mol-1
参考答案:C
本题解析:
本题难度:一般