微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知可逆反应:M(g)+N(g) P(g)+Q(g)△H>0,请回答下列问题:
P(g)+Q(g)△H>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M) =1mol·L-1,c(N)=2.4mol·L-1,达到平衡后,M的转化 率为60%,此时N的转化率为____。
(2)若反应温度升高,M的转化率___(填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol·L-1,c(N) =amol·L-1;达到平衡后,
c(P)=2mol·L-1,a=____。
(4)若反应温度不变,反应物的起始浓度为:c(M) =c(N) =bmol·L-1,达到平衡后,M的转化率为____。
2、填空题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为CrO42- Cr2O72-
Cr2O72-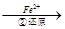 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42- (黄色)+2H+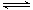 Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O72-和CrO42-的浓度相同?
b.2v(Cr2O72-)=v(CrO42-)?
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) 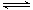 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为__________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_________________________________。溶液中同时生成的沉淀还有__________。
3、填空题 (11分)在一定温度下,向一个容积不变的密闭容器中加入?2 molA?和?2 molB?,发生反应:2A(g) + B(g) 3C( g)?ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为?bkJ,B的体积分数为ω1%。试回答:
3C( g)?ΔH=-a kJ/mol(a>0),达到平衡时放出的热量为?bkJ,B的体积分数为ω1%。试回答:
(1)该反应平衡常数K表达式为________________________。?a与b的关系是a?b(填“>”、“<”、“=”)。
(2)若升高温度,平衡常数K__________(填“增大”、“减小”或“不变”,下同),达到平衡时B的体积分数_________。
(3)下列说法中能表明该反应已达到平衡状态的是_________。
A.温度和体积一定 时,容器内压强不再变化
时,容器内压强不再变化
B.温度和体积一定时,某一物质浓度不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化