微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于氯气、氯水的叙述中正确的是(?)
A.氯气、液氯、氯水是同一种物质
B.新制氯水可以使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,逸出的气体是氯气
D.新制氯水放置数天后pH变大
参考答案:B
本题解析:氯气溶于水即得到氯水,即氯水是混合物,A不正确;次氯酸具有强氧化性,氯水中的盐酸具有酸性,所以新制氯水可以使蓝色石蕊试纸先变红后褪色,B正确;次氯酸不稳定,见光分解生成氯化氢和氧气,则溢出的气体是氧气,C不正确;随着次氯酸的分解,氯水逐渐变为稀盐酸,所以酸性增强,漂白性逐渐减弱,直至消失,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确氯水的制备、组成微粒以及相应微粒的性质,然后结合题意灵活运用即可。
本题难度:一般
2、填空题 某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下:
(1)写出该反应的化学方程式______;反应中,氧化剂和还原剂的物质的量之比为______
(2)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是(填序号)______?
A.氢氧化钠溶液?B.碳酸钠浓溶液
C.浓硫酸?D.饱和氯化纳溶液.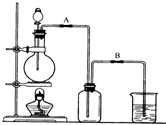
参考答案:(1)浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,其反应为MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
该反应中化合价的变化为:MnO2→MnCl2 ,锰元素由+4价→+2价,1mol二氧化锰得2mol电子;
HCl→Cl↑,氯元素由-1价→0价,1molHCl失去1mol电子,所以其最小公倍数为2,二氧化锰的计量数为1,作还原剂的HCl的计量数为2,物质的量之比等于计量数之比,所以氧化剂和还原剂的物质的量之比为 1:2.
故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;1:2;
(2)氯气和水反应生成盐酸和次氯酸,盐酸和次氯酸具有酸性,盐酸是强酸,能和碱或弱酸盐反应,而氯气不与浓硫酸、氯化钠反应,则不能用来吸收残余氯气.
故答案为:CD.
本题解析:
本题难度:简单
3、填空题 新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其组成,做了如下实验,回答:
(1)往用水湿润的红纸中滴入少量新制饱和氯水,观察到______现象,说明饱和氯水中含有______.
(2)在试管中加入少量的块状碳酸钙,再加入适量饱和氯水,充分反应,有少量气泡产生,用离子方程式解释此现象______.
参考答案:(1)氯气溶于水发生反应Cl2+H2O?HCl+HClO,其中HClO具有漂白性,可使红色纸张褪色,故答案为:纸张红色褪去;HClO;
(2)氯气和水反应生成盐酸和次氯酸,其中盐酸酸性比碳酸强,次氯酸酸性比碳酸弱,加入碳酸钙与盐酸反应生成二氧化碳气体,
反应的离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O.
本题解析:
本题难度:一般
4、填空题 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
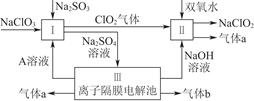
(1)双氧水的结构式为____________;Ⅰ中发生反应的还原剂是__________(填化学式)。
(2)Ⅱ中反应的离子方程式是_____________________________________________________________________________________________________________________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式:________________________________________________________________________________________________________________________________________________。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2。用离子方程式解释产生Cl2的原因:________________________________________________________________________
________________________________________________________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量NaClO2,其中一份给以适当条件使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量________(填“相同”“不相同”或“无法判断”)。
参考答案:(1)H—O—O—H Na2SO3
(2)2ClO2 +H2O2+2OH-=2ClO2-+O2↑+2H2O
(3)H2SO4 阳
(4)5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O? ClO2-+3Cl-+4H+=2Cl2↑+2H2O
(5)相同
本题解析:(1)NaClO3中Cl原子化合价为+5价,具有很强的氧化性,而SO32-在酸性条件下具有较强的还原性,故Ⅰ中发生反应的氧化剂是NaClO3,还原剂是Na2SO3;(2)电解Na2SO4溶液相当于电解水,由气体a、b是Na2SO4溶液的电解产物可知为H2和O2,由气体a为反应Ⅱ的产物之一可知其为O2,为H2O2被ClO2氧化得到的产物,故反应Ⅱ的反应物为ClO2、H2O2和NaOH,生成物有NaClO2和O2,根据电子守恒和原子守恒配平即可;(3)电解Na2SO4溶液时OH-在阴极生成,故Na+通过离子隔膜向阴极移动得到产物NaOH溶液,而阳极生成H+,SO42-向阳极移动得到产物A(即H2SO4溶液);(4)①由题意可知反应物为NaClO2和HCl,其中NaClO2中Cl元素的化合价为+3价,既可升高也可降低,故反应为NaClO2自身的氧化还原反应,根据电子守恒可知氧化产物ClO2和还原产物Cl-的物质的量之比为4∶1,根据原子守恒将方程式配平即可;②若产物为Cl2则ClO2-和HCl发生了归中反应,根据电子守恒可知反应的ClO2-和HCl的物质的量之比为3∶1,根据原子守恒将方程式配平即可;(5)变质过程为NaClO2自身的氧化还原反应,无论变质与否,与Fe2+反应时氯元素最终都转化为Cl-,故转移电子数相等。
本题难度:困难
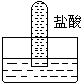
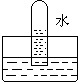
5、选择题 四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如图所示,其中充满Cl2的试管是( )
A.
B.
C.

D.
参考答案:A、氨气极易溶于水且与盐酸反应,可充满试管,A是氨气,故A不选;
B、二氧化氮与水反应生成硝酸和一氧化氮,一氧化氮不溶于水,所以试管中仍存在气体,B是二氧化氮,故B不选;
C、氯气不溶于饱和食盐水,但微溶于水,1体积水可溶解2体积Cl2,故C选;
D、O2难溶于水,可用排水法收集,D是O2,故D不选.
故选C.
本题解析:
本题难度:简单