微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)用方程式表示工业上用石灰石、氯气为原料生产漂白粉的原理_________________
_________________________ ______________________________,漂白粉的有效成分是(填化学式)?
______________________________,漂白粉的有效成分是(填化学式)?
(2)漂白粉可用于饮用水或环境消毒,它溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,写出相应的化学方程式:___________________
(3)浓盐酸和次氯 酸钙能发生下列反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,该反应中转移的电子数为___________
酸钙能发生下列反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,该反应中转移的电子数为___________
A.①②③
B.②③④
C.②③
D.①④
参考答案:
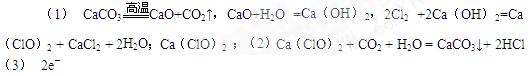
本题解析:略
本题难度:一般
2、简答题 下列叙述正确的是( )
①73Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为3:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1.
A.①②
B.②③
C.①③
D.③④
参考答案:①73Li+中含有的中子数为4与电子数为2,中子数与电子数之比为2:1,故①正确;
②在C2H6分子中极性共价键有6个,非极性共价键有1个,两者数目之比为6:1,故②错误;
③甲烷(CH4)气体中含有的氢、碳原子数之比为4:1,故③正确;
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为3:1.故④错误;
故选C.
本题解析:
本题难度:一般
3、计算题 甲、乙两位学生用加热氯酸钾的方法制取氧气。甲取了一定质量的氯酸钾和0.10 g二氧化锰,经混合后装入试管中加热,待收集到所需氧气时停止加热。试管冷却后,乙称得甲留下的反应混合物的质量为4.04 g,将它继续加热,直到氯酸钾全部分解,得到氧气672 mL(标准状况)。求甲实验时氯酸钾分解的百分率。
参考答案:50%
本题解析:从题给已知条件可知,解题时应从乙得到的氧气的量入手。
设乙分解KClO3的质量为x,甲分解KClO3的质量为y。
2KClO3?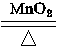 ?2KCl + 3O2↑
?2KCl + 3O2↑
2 mol×122.5? 2 mol×74.5 ?3 mol×22.4
g·mol-1?g·mol-1?L·mol-1
x? 0.672 L
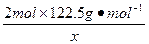 =
=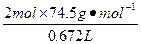
解得:x="2.45" g
在4.04 g混合物中:m(KCl)="4.04" g-0.10 g-2.45 g="1.49" g。即甲分解KClO3时得到的KCl质量为1.49 g,由此可计算y:
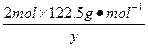 =
=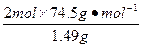
解得:y="2.45" g。
故甲实验时KClO3分解的百分率为:
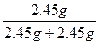 ×100%=50%。
×100%=50%。
本题若从物质的量入手计算会更简便。
解:设乙分解KClO3的物质的量为x,甲分解KClO3的物质的量为y。
2KClO3?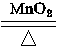 ?2KCl + 3O2↑
?2KCl + 3O2↑
2 mol? 2 mol? 3 mol
X?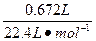
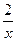 =
=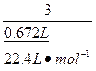 , 解得:x="0.02" mol
, 解得:x="0.02" mol
在4.04 g混合物中:m(KCl)="4.04" g-0.10 g-(0.02 mol×122.5 g·mol-1)="1.49" g。即甲分解KClO3得到的KCl的质量为1.49 g,由此计算y:
2KClO3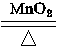 2KCl+3O2↑
2KCl+3O2↑
2 mol? 2 mol
y?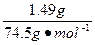
解得:y="0.02" mol
故甲实验时KClO3分解的百分率为:
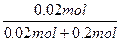 ×100%=50%。
×100%=50%。
本题难度:简单
4、选择题 在室温条件下,保存下列药品的方法不正确的是(?)
A.氢氧化钠用带玻璃塞的玻璃瓶保存
B.保存液溴要加少量水形成液封
C.硝酸银溶液装在棕色瓶中避光保存
D.钠保存在煤油中
参考答案:A
本题解析:液溴水封、AgNO3棕色瓶避光保存、Na保存在煤油中都是正确的,而NaOH用玻璃塞易黏结,故A错。
本题难度:简单
5、选择题 光具有能量,能影响很多反应。下列反应中,受光照影响显著的是
A.乙醇与乙酸的酯化反应
B.甲烷与氧气的反应
C.铁与氯气的反应
D.次氯酸的分解
参考答案:D
本题解析:A选项反应的条件是在加热,浓硫酸做催化剂的条件下进行。B选项是在点燃的情况下进行。C选项是在点燃的情况下。D选项次氯酸不稳定在光照的条件下能受热分解。所以答案选D
本题难度:简单