| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《物质的量》试题强化练习(2017年最新版)(十)
参考答案:B 本题解析:溶液稀释过程中溶质物质的量不变则有C1V1=C2V2,NO3-的物质的量是Mg(NO3)2的2倍代入题中数据得关系式5mol/L×2×aml=C2×bml,解得C2=10a/bmol/L,选B. 本题难度:一般 3、选择题 氧气与甲烷的混合气体中,若氧气与甲烷的质量比为4:1(极易爆炸),则其体积比为 |
参考答案:A
本题解析:氧气和甲烷的的物质的量比例为4/32:1/16=2:1,选A。
考点:阿伏伽德罗定律。
本题难度:一般
4、选择题 在相同条件下,下列各组气体中分子数相同的是(? )
A.14 g N2和32 g O2
B.34 g NH3和4 g H2
C.2 L CO2和2 L H2O
D.11.2 L O2和0.5 mol O2
参考答案:B
本题解析:可以直接比较其物质的量,物质的量相同,其 分子数即相同。
本题难度:简单
5、计算题 (10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示: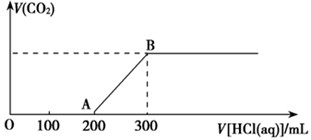
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式______________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
参考答案:(1)Na2CO3或NaHCO3(2分)NaOH和Na2CO3或Na2CO3和NaHCO3(2分)
(2)①OH-+H+===H2O(2分),CO+H+===HCO(2分)
②1.2 mol·L-1(2分,不写单位不得分)
本题解析:(1)CO2和氢氧化钠溶液反应,可以生成碳酸钠,也可以生成碳酸氢钠。所以如果是单一成分,则可以是Na2CO3或NaHCO3;如果是多种成分,则可以是NaOH和Na2CO3或Na2CO3和NaHCO3。
(2)由于碳酸钠和盐酸反应是分步进行的,方程式为Na2CO3+HCl=NaCl=NaHCO3、NaHCO3+HCl=NaCl+H2O+CO2↑。根据图像可知,生成CO2消耗盐酸的物质的量小于前面消耗的,这说明溶液中的溶质是氢氧化钠和碳酸钠。所以O到A点发生反应的离子方程式是OH- + H+ = H2O、CO32-+ H+ = HCO3-。
(3)根据图像可知最终溶液中生成的是氯化钠。根据原子守恒可知,氯化钠是0.3L×2mol/L=0.6mol,所以再根据原子守恒可知,氢氧化钠元也是0.6mol,则浓度是0.6mol÷0.5L=1.2mol/L。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质结构与性质》.. | |