| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《盐类水解的原理》试题预测(2017年最新版)(九)
2、选择题 根据右表,以下错误的是
B.0.10 mol/L的溶液,pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4 C.0.10 mol/L的H3PO4溶液中,0.30 mol/L>c(H+)>0.10 mol/L D.25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者 3、选择题 结构简式为 4、选择题 12.下列盐溶液蒸干后并灼烧,能得到原溶质的是 |
5、填空题 (本题共13分)
氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:N2 +3H2 2NH3
2NH3
29.已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是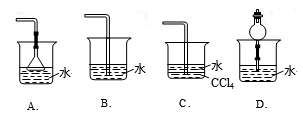
30.某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。若开始时充入:0.1mol N2、0.1mol H2和0.2mol NH3,则此时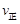
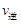 (填“>”或“<”或“=”,已知该温度下,平衡常数K值为
(填“>”或“<”或“=”,已知该温度下,平衡常数K值为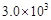 )。
)。
若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是 (填字母代号)。
A.压缩容器体积 B.适当升高温度
C.通入适量氮气 D.加适量催化剂
31.能说明上述反应达到平衡状态的是
A.2υ (H2)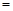 3υ(NH3)
3υ(NH3)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.单位时间内生成n mol N2的同时生成2n mol NH3
32.氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),NH3·H2O的电离程度 ,电离平衡常数 ,溶液的pH值 。
33.氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡 (用离子方程式表示),该稀溶液中水的电离度约为 。
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质的量》.. | |