微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 我校某化学小组欲设计实验检验浓H2SO4和木炭反应的所有产物:
(1)写出浓H2SO4和木炭反应的化学方程式_____________
(2)请你从下图中选用所需的仪器(可重复使用)组成一套装置帮助该小组实现他们的目的.现提供浓H2SO4、木炭和酸性KMnO4溶液,无水硫酸铜,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)?
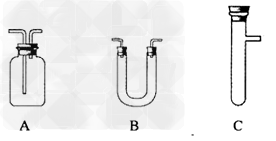
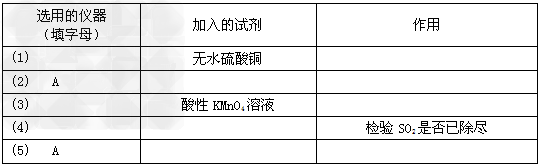
将所选的仪器按连接顺序由上至下依次填入下表(可以不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
参考答案:(1)2?H2SO4?(浓)?+?C CO2↑+?2?H2O?+?2SO2↑
CO2↑+?2?H2O?+?2SO2↑
(2)
本题解析:
本题难度:一般
2、填空题 提供下列四种试剂:①氢氧化钠溶液(质量分数为50%),②浓盐酸、③浓硫酸、④浓硝酸,取三种金属:A.铁片、B.铜片、C.铝片(表面用砂纸打磨过)做实验:
(1)若要证明三种金属的活动性强弱,可选用的试剂编号为______
(2)室温下,将三种金属分别投入上述某种试剂中,均不能观察到明显的现象,这种试剂的编号是______
(3)有一种试剂只能和上述三种金属中的一种发生化学反应,该试剂的编号是______,该反应的氧化剂是______
(4)室温下,有一种试剂能和三种金属发生反应,该试剂的编号是______,其中有一种金属反应的现象最为明显,可以观察到______?现象,另外两种金属反应现象不明显的原因是______.
参考答案:(1)氢氧化钠制与铝反应,浓硫酸、浓硝酸在常温下与铁和铜发生钝化现象,所以根据浓盐酸与铁、铝反应快慢比较金属性,铜不与浓盐酸反应,进行比较金属的活泼性,故答案为:②;
(2)室温下,将三种金属分别投入上述某种试剂中,均不能观察到明显的现象,室温下浓硫酸不和铜反应,铁和铝在浓硫酸中钝化,故答案为:③;
(3)试剂只能和上述三种金属中的一种发生化学反应,是氢氧化钠溶液和铝的反应,2Al+2H2O+2H2O=2NaAlO2+3H2↑反应过程中水做氧化剂,
故答案为:①;H2O;
(4)和三种金属发生反应的试剂是浓硝酸,具有强氧化性,铁和铝常温下在浓硫酸、浓硝酸中发生钝化现象,铜和浓硝酸反应生成二氧化氮红棕色气体,和蓝色硝酸铜溶液,铁和铝在常温下在浓硫酸、浓硝酸中发生钝化现象在金属表面形成一薄层致密氧化物薄膜,阻止反应进行,
故答案为:④;有红棕色气体生成,溶液由无色变为蓝色,常温下产生钝化现象.
本题解析:
本题难度:一般
3、实验题 利用下图进行浓硫酸与铜反应,并验证二氧化硫的性质。
实验操作如下:连接仪器和安放药品,用酒精灯加热1分钟后撤去酒精灯,将铜丝伸入液面以下,一段时间后拉起铜丝。
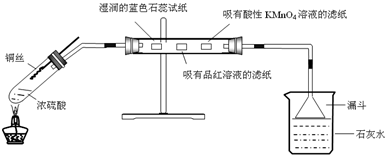
请回答下列问题:
(1)将反应后的试管充分静置,观察到试管底部有白色固体出现,中间层是浅黄色液体(浓硫酸),上层是蓝色溶液。白色固体的化学式为?,上述现象中体现了浓硫酸的性质有?(填序号)
①酸性?②强氧化性?③吸水性?④脱水性
(2)直玻璃管中依次观察到的现象是:?;
?;?。
(3)某次实验中小烧杯中澄清石灰水始终未观察到浑浊,你猜想可能的原因是?,请设计实验证明它?。
(4)某学生发现,常温下将铜片长时间放入浓硫酸的试管中并密封,最终生成黑色物质(Cu2S)和蓝色溶液,无气体生成,写出此条件下铜片与浓硫酸反应的化学方程式:?。
参考答案:(1)CuSO4(2分),①②③(2分)
(2)蓝色石蕊试纸变为红色(2分);红色滤纸变为白色(2分);
紫红色滤纸变为白色(2分)
(3)SO2易溶于水,大量SO2与Ca(OH)2生成易溶于水的Ca(HSO3)2而不产生CaSO3浑浊(2分);取小烧杯中溶液少许于另一支试管中,加入足量NaOH溶液,若有白色沉淀生成,则证明猜想合理(3分)。
(4)5Cu+4H2SO4(浓)=Cu2S+3CuSO4+4H2O(3分)
本题解析:考查SO2的制取及性质:铜与浓硫酸的反应为:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
(1)在上述反应中,浓硫酸部分被还原为SO2,呈现氧化性,部分体现酸性,生成CuSO4,试管低部的白色固体为硫酸铜固体,说明浓硫酸可将CuSO4·5H2O的水可吸收掉,体现了浓硫酸的吸水性
(2)SO2为酸性氧化物,遇水生成中强酸:SO2+H2O=H2SO3,可使蓝色石蕊试纸变为红色;SO2具有漂白性,可漂白品红试纸;SO2具有还原性,可将KMnO4紫色溶液还原为无色
(3)当碱过量时,生成白色浑浊:SO2+Ca(OH)2=CaSO3↓=H2O,但当有大量SO2与石灰水反应时,Ca(OH)2+2SO2=Ca(HSO3)2,Ca(HSO3)2易溶于水,并无浑浊出现
酸式盐Ca(HSO3)2可与碱反应生成不溶于水的CaSO3:故可取小烧杯中溶液少许于另一支试管中,加入足量NaOH溶液,若有白色沉淀生成,则证明猜想合理
(4)根据化合价的升降守恒,可配平此反应:5Cu+4H2SO4(浓)=Cu2S+3CuSO4+4H2O
本题难度:一般
4、实验题 (8分)乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.100 0 mol·L-1的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
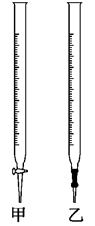
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志可以是_________________________________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
参考答案:(1)甲(2分)
(2)当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点(2分)
(3)2(2分) 偏大(1分) 偏小(1分)
本题解析:(1)酸性KMnO4标准液具有强氧化性,可腐蚀橡胶管,所以它应该装在酸式滴定管中,即甲管
(3)2MnO?~? 5H2C2O4
_? 0.1×0.01?
可知:x=2
由上式可看出,当KMnO4溶液的用量偏大时,x的值将偏小,所以:
①滴定终点时俯视滴定管刻度,使KMnO4溶液的体积偏小,x的值将偏大
②KMnO4溶液因久置而导致浓度变小,则其所耗体积偏大,x的值将偏小
本题难度:一般
5、选择题 如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
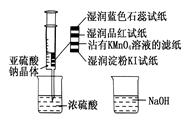
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性
C.湿润淀粉KI试纸变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
参考答案:D
本题解析:略
本题难度:一般