微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,在体积为2L的密闭容器中加入1molX和1molY进行如下反应:
X(g)+Y(g)  2Z(g)+W(s) △H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol·L-1。下列判断正确的是
2Z(g)+W(s) △H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol·L-1。下列判断正确的是
A.若向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后再加入X,上述反应的△H增大
C.温度不变,将容器的体积扩大一倍,Z的平衡浓度变为原来的1/2
D.2min时,用Y表示的反应速率为0.2mol·L-1·min-1
参考答案:C
本题解析:略
本题难度:一般
2、选择题 反应:L(s)+aG(g)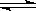 bR(g)?达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断(?)
bR(g)?达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断(?)

A.上述反应 △H<0
B.上述反应△H>0
C.a>b
D.a<b
参考答案:BD
本题解析:反应:L(s)+aG(g)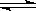 bR(g) 图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,看等温线,随着压强增大,平衡向体积减小的方向移动,G的体积分数减小,说明平衡向正反应方向移动,即a<b;看等压线p1或p2,随着温度升高,平衡向吸热方向移动,G的体积分数减小,说明平衡向正反应方向移动,即△H>0,故选B D。
bR(g) 图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,看等温线,随着压强增大,平衡向体积减小的方向移动,G的体积分数减小,说明平衡向正反应方向移动,即a<b;看等压线p1或p2,随着温度升高,平衡向吸热方向移动,G的体积分数减小,说明平衡向正反应方向移动,即△H>0,故选B D。
点评:在此总结一下对于化学平衡的有关图象问题的分析方法:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
(2)紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平,数值大。例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系
本题难度:简单
3、选择题 X、Y、Z为三种气体,把a?mol?X和b?mol?Y充入一密闭容器中,发生反应X+2Y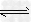 2Z.达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
2Z.达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为
[? ]
A.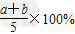 ?
?
B.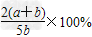
C.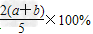 ?
?
D.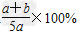
参考答案:B
本题解析:
本题难度:一般
4、填空题 (8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题:
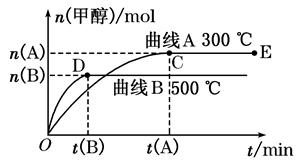
(1)反应达到平衡时,平衡常数表达式K=_________________,升高温度,K值___________(填“增大”、“减小”或“不变”),平衡向?方向移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(选填选项字母)。
A.氢气的浓度减少
B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加
D.重新平衡时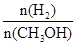 增大
增大