微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)FeO42-与水反应的方程式为:4FeO42- + 10H2O  ?4Fe(OH)3 + 8OH-+ 3O2,
?4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是?和?。

(2)将适量K2FeO4配制成c(FeO42-) =1.0×10-3 mol·L-1(1.0mmol·L-1)的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。题(1)中的反应为FeO42-变化的主反应,该反应的△H?0。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是?(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4- H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近?(填字母)。
H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近?(填字母)。
A.10-2.5?B.10-6?C.10-7?D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL,1.0×10-3 mol·L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量为?mol,
完全沉淀后溶液中残留的c(FeO42- )为______________。
参考答案:(1)杀菌消毒,吸附杂质(2)>(3)BD(4)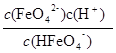 ?C(5)4.536×10-5,1×10-5mol/L
?C(5)4.536×10-5,1×10-5mol/L
本题解析:(1)FeO42-具有强氧化性,能消毒杀菌;FeO42-与水生成的Fe(OH)3胶体能吸附水中的悬浮物,使水体净化。(2)由图I可以看出,温度越高,溶液中c(FeO42-)越小,说明升高温度,平衡向右移动,所以正反应是吸热反应。(3)由图可知当pH小于1.5时,溶液中只有H3FeO4+和H2FeO4,A错误;pH由10降至4时,HFeO4-的分布分数先增大后减小,B正确;向pH=8的该溶液中加KOH溶液,pH增大,离子方程式为HFeO4-+OH-=FeO42-+H2O,C错误;pH约为2.5 时, H3FeO4+和HFeO4-分布分数相等,D正确。(4)HFeO4- H++FeO42-的电离平衡常数K=
H++FeO42-的电离平衡常数K=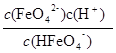 ,当pH接近7时,c(FeO42-)=c(HFeO4-),K≈10-7。(5)要形成CaFeO4沉淀,必须c(Ca2+)·c(FeO42-)>Ksp(CaFeO4)。
,当pH接近7时,c(FeO42-)=c(HFeO4-),K≈10-7。(5)要形成CaFeO4沉淀,必须c(Ca2+)·c(FeO42-)>Ksp(CaFeO4)。
点评:勒沙特列原理适用于所有平衡体系;两种溶液混合,形成沉淀的条件是Q>Ksp。
本题难度:困难
2、选择题 某温度下,在一个2L的密闭容器中,加入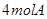 和
和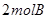 进行如下反应:
进行如下反应:
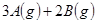

 ,反应一段时间后达到平衡,测得生成
,反应一段时间后达到平衡,测得生成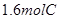 ,则下列说法正确的是
,则下列说法正确的是
A.该反应的化学平衡常数表达式是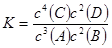
B.此时,B的平衡转化率是40%
C.增大该体系的压强,化学平衡常数增大
D.增加B,B的平衡转化率增大
参考答案:B
本题解析:物质C是固体,不能出现在平衡常数的表达式中,A不正确。生成1.6mol的C,则消耗B是0.8mol,所以转化率是0.8÷2×100%=40%,选项B正确。平衡常数只与温度有关系,C不正确。增加B的量,平衡向正反应方向移动,提高A的转化率,但降低B的转化率,D不正确,答案选B。
本题难度:一般
3、填空题 (14分)
工业合成氨反应:N2+3H2 2NH3,在一定条件下已达到平衡状态。
2NH3,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为?。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)="1.2mol," n(H2)="1.2mol," n (NH3)=0.8mol,则反应速率V(N2)=?mol·L-1·min-1,H2的转化率=?,平衡常数=?。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡?(填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为?mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N2?3mol,H2 =?mol(平衡时NH3的质量分数与前者相同);若开始时通入x molN2﹑6molH2和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=?mol,y=?mol(用含a的代数式表示)
参考答案:(14分)
(1) N2(g) +3H2(g)  2NH3(g),△H=-92.4KJ·mol-1
2NH3(g),△H=-92.4KJ·mol-1
(2) 0.04? 50%? 1.23?向右
(3)? 1-a/2? 9? 2? 3-3a/2
本题解析:略
本题难度:一般
4、填空题 (6分)在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  ?2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液, 溶液呈橙色。
?2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液, 溶液呈橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈_______色,平衡________。(填“向左移”或“向右移”,下同。)
(2)再加入过量稀H2SO4,则溶液呈_______色,平衡________。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡_______________,溶液颜色将__________。
参考答案:(1)黄色、向右移(2)橙红色、向左移(3)向右移变浅
本题解析:向上述溶液中加入NaOH溶液,中和H+平衡向正反应方向移动,黄色的CrO42-变多,溶液呈黄色。(1)中再加入过量稀H2SO4,平衡向逆反应方向移动,溶液呈橙红色。C(CrO42-)变小平衡向正反应方向移动,溶液颜色变浅,因为浓度变小了。
本题难度:一般
5、填空题 (12分)在一个2L的密闭容器中,投入反应物,发生反应2SO3(g) 2SO2(g)+O2(g)? ΔH>0,其中SO3的变化如下图所示:
2SO2(g)+O2(g)? ΔH>0,其中SO3的变化如下图所示:
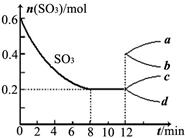
(1)写出该反应的平衡常数表达式并根据8min时到达平衡计算出结果?。
(2)用O2表示0到8min内该反应的平均速率v=?。
(3)能说明该反应已达到平衡状态的是?。
A.v(SO3)=2v(O2) ? B.容器内压强保持不变
C.v(SO2)逆=2v(O2)正?D.容器内密度保持不变
(4)在第12min时,容器压缩到1L,则SO3的变化曲线为?。
A.a? B.b? C.c? D.d
(5)若保持容积不变在第12min时,加入SO3(g),则平衡向?反应方向移动(填“正”或“逆”)。SO3的体积分数?(填“增大”或“减小”)。
参考答案:(1)K= = 0.4?(2)0.0125 mol/(L·min)
= 0.4?(2)0.0125 mol/(L·min)
(3)B、C?(4)C?(5)正?增大
本题解析:(1)K= ,8分钟时c(SO3)=0.1mol/L,则c(SO2)=0.2mol/L,c(O2)=0.1mol/L,所以K=0.4。
,8分钟时c(SO3)=0.1mol/L,则c(SO2)=0.2mol/L,c(O2)=0.1mol/L,所以K=0.4。
(2)v(O2)=
(3)反应前后压强不等,所以可以用压强不再变化判断反应达平衡,v(SO2)逆=2v(O2)正,正逆反应速率相等,可以判断反应达平衡,因此选BC。
(4)容器压缩的瞬间,SO3物质的量不变,随即平衡逆向移动,SO3的物质的量增大,所以c曲线符合。
(5)若保持容积不变在第12min时,加入SO3(g),相当于对体系加压,平衡正向移动,但SO3的体积分数增大。
点评:本题非常基础,只要掌握影响平衡移动的因素即可。
本题难度:一般