微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法不正确的是:
A. 室温下不能自发进行,说明该反应的
室温下不能自发进行,说明该反应的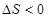
B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
C.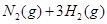

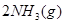
 ,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大
,其他条件不变时升高温度,反应速率v(H2)和v(NH3)均增大
D.水的离子积常数KW随着温度的升高而增大,说明水的电离是吸热过程
2、实验题 (15分)50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在右图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算反应热。

请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是?;(由图可知该装置有两处不妥之处:(1)??。(2 )?。
(2)烧杯间填满碎塑料泡沫的作用是________。
(3)大烧杯上如不盖硬纸板,则求得的反应热数值___。(填“偏大”、“偏小’、“无影响”)。
(4)若实验过程中,测得盐酸和NaOH溶液的起始温度的平均值为25.2℃.溶液混合后的最高温度为28.6℃.试经过计算写出表示该反应中和热的热化学方程式:________?
(混合溶液的比热容c=4.18J/(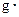 ℃),盐酸和NaOH溶液的密度认为都是1
℃),盐酸和NaOH溶液的密度认为都是1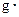
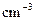 )
)
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会____(填“偏大”、“偏小”、“无影响”)。
3、选择题 下列叙述正确的是(?)
A.同温同压下,4Al(s)+3O2(g)===2Al2O3(s)在常温和点燃条件下的ΔH不同
B.在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应放热,△H>0
C.已知C(s)+1/2O2(g)="CO(g);" △H =-110.5kJ·mol-1,则碳的标准燃烧热是△H =-110.5kJ·mol-1
D.新能源应具有资源丰富、可再生、无污染或少污染等特点。如太阳能、氢能、风能、地热能、潮汐能和生物质能等新能源
4、选择题 将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2="50" mL)。下列叙述正确的是( )
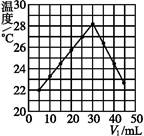
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
5、选择题 热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量
B.1mol碳和1mol水反应生成一氧化碳和氢气,并吸收131.3kJ热量
C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ