微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为?
A.H2SO4(浓) > Cu2+ > Fe3+ > Br2
B.H2SO4(浓) > Br2 > Fe3+ > Cu2+
C.Br2 > H2SO4(浓) > Cu2+ > Fe3+
D.Cu2+ > Fe3+ > Br2 > H2SO4(浓)
参考答案:B
本题解析:本题是比较氧化性强弱,运用氧化剂的氧化性大于氧化产物,区分氧化剂和氧化产物;氧化剂:反应物中含有元素化合价降低的物质;氧化产物:还原剂失去电子后(化合价升高)所得的产物,由题干可知:氧化性H2SO4(浓) > Cu2+, Fe3+ > Cu2+,H2SO4(浓) > Br2,Br2 > Fe3+,综上所述,H2SO4(浓) > Br2 > Fe3+ > Cu2+,A.错误;B.正确;C.错误;D.错误。
本题难度:一般
2、选择题 O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是? ( )。
A.配平后的离子方程式为2O3+2I-+4H+=I2+2O2+2H2O
B.每生成1 mol I2转移电子2 mol
C.O2是还原产物之一
D.该反应能说明O2的氧化性大于I2的
参考答案:B
本题解析:A项中方程式虽然满足原子守恒,但不满足电子守恒和电荷守恒,配平后正确的离子方程式为O3+2I-+2H+=I2+O2+H2O,故每生成1 mol I2转移电子2 mol,A项错误, B项正确;O3和O2中O的化合价均为0,故O2既不是氧化产物,也不是还原产物,C项错误;该反应能说明O3的氧化性大于I2的,而不能说明O2的氧化性大于I2的,D项错误。
本题难度:一般
3、实验题 某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
操 作
| 现 象
|
取0.1 mol/L的FeBr2溶液10 mL,测溶液的pH
| pH试纸变红(约为4)
|
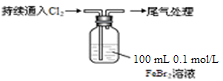
|
|
参考答案:
本题解析:
本题难度:困难
4、填空题 (1)等物质的量的下列化合物与足量浓盐酸反应,得到氯气的物质的量最多的是
________(填序号)。
已知:MnO4-+H++Cl-
参考答案:
本题解析:
本题难度:一般
5、选择题 根据下列三个反应的化学方程式,下列关系式正确的是( )
①I2+SO2+2H2O=H2SO4+2HI?②2FeCl3+2HI=2FeCl2+2HCl+I2?③2FeCl2+Cl2=2FeCl3.
A.氧化性:Fe3+>Cl2>H2SO4>I2
B.还原性:SO2>I->Fe2+>Cl-
C.Fe与I2化合:2Fe+3I2=2FeI3
D.FeI2溶液中通入一定量的Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
参考答案:①I2+SO2+2H2O=H2SO4+2HI中氧化性I2>H2SO4,还原性SO2>I-,
②2FeCl3+2HI=2FeCl2+2HCl+I2中氧化性Fe3+>I2,还原性I->Fe2+,
③2FeCl2+Cl2=2FeCl3中氧化性Cl2>Fe3+,还原性Fe2+>Cl-,
A、氧化性大小为Cl2>Fe3+>I2>H2SO4,故A错误;
B、还原性大小为SO2>I->Fe2+>Cl-,故B正确;
C、因Fe3+与I-发生氧化还原反应,则Fe与I2化合发生Fe+I2=FeI2,故C错误;
D、氯气应优先氧化碘离子,氯气少量时发生2I-+Cl2=I2+Cl-,氯气过量时发生Fe2++2I-+2Cl2=Fe3++I2+4Cl-,故D错误;
故选B.
本题解析:
本题难度:简单