微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:① 向KMnO4晶体滴加浓盐酸,产生黄绿色气体;② 向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③ 取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝。下列判断正确的为
[? ]
A.上述实验证明氧化性:MnO4->Cl2>Fe 2+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
参考答案:A
本题解析:
本题难度:一般
2、选择题 在浓盐酸中H3AsO3与SnCl2反应的离子方程3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M.关于该反应的说法中正确的组合是( )①氧化剂是H3AsO3;②还原性:Cl->As;③每生成0.1mol?As,反应中转移的电子的物质的量为0.3?mol.④M为OH-.
A.①③
B.①②④
C.②③④
D.只有①
参考答案:应为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M.
对于反应3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M.
①反应中只有As元素化合价降低,由H3AsO3中+3价降低为0价,所以H3AsO3是氧化剂,故①正确;
②反应中只有Sn元素化合价升高,由SnCl2中+2价升高为SnCl62+中+4价,所以SnCl2是还原剂,反应中只有As元素化合价降低,由H3AsO3中+3价降低为0价,所以H3AsO3是氧化剂,所以还原产物为As,还原性SnCl2>As;反应中氯元素化合价为发生变化,故②错误;
③反应中只有As元素化合价降低,被还原,由H3AsO3中+3价降低为0价,每生成0.1mol?As,反应中转移的电子的物质的量为0.1mol×3=0.3?mol,故③正确;
④根据元素守恒可知,M应为H2O,故④错误.
故①③正确.
故选:A.
本题解析:
本题难度:简单
3、选择题 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法正确的是(?)

A.还原性I->Fe2->Br-
B.原混合溶液中c(FeBr2) = 4mol/L
C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:2Fe2+ + 2I- + 2Cl2 → 2Fe3+ + I2 + 4 Cl-
D.原溶液中n(Fe2+) :n(I-) :n(Br-) =" 2" :1 :3
参考答案:B
本题解析:A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6mol降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;C.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C正确;D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确.
本题难度:一般
4、选择题 下列化学反应中,属于氧化还原反应的是
A.Na2CO3+CaCl2=CaCO3↓+2NaCl
B.2Cu+O2=2CuO
C.CaCO3+2HCl=H2O+CO2↑+CaCl2
D.2H2+O2=2H2O
参考答案:BD
本题解析:A.Na2CO3+CaCl2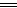 CaCO3↓+2NaCl(复分解反应)。
CaCO3↓+2NaCl(复分解反应)。
B.2Cu+O2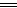 2CuO(氧化还原反应)。
2CuO(氧化还原反应)。
C.CaCO3+2HCl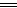 H2O+CO2↑+CaCl2(复分解反应)。
H2O+CO2↑+CaCl2(复分解反应)。
D.2H2+O2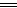 2H2O(氧化还原反应)。
2H2O(氧化还原反应)。
本题难度:简单
5、填空题 某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X.
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______________________.
(2)已知0.2mol?KBrO3在反应中得到1mol电子生成X,则X的化学式为______________.
(3)根据上述反应可推知________________.
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3 c.还原性:AsH3>X d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:______+_____
参考答案:(1)AsH3
(2)Br2
(3)ac
(4)
本题解析:
本题难度:一般