微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
[? ]
A.液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B.阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同
C.甲烷、白磷的分子都是正四面体结构,因此它们分子中化学键之间的夹角相同
D.若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+11
参考答案:D
本题解析:
本题难度:一般
2、填空题 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1mol XY2含有54 mol电子。
(1)该融雪剂的化学式是_______________;X与氢元素形成的化合物的电子式是______________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
_______________;D与E能形成一种非极性分子,该分子的结构式为_______________;D所在族元素的氢化物中,沸点最低的是_______________。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价健;W与Z能形成一种新型无机非金属材料,其化学式是_______________。
参考答案:(1)CaCl2;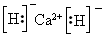
(2)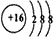 ;S=C=S;H2S
;S=C=S;H2S
(3)Si3N4
本题解析:
本题难度:一般
3、选择题 按C、N、O、F的顺序,下列递变规律正确的是( )
A.原子半径逐渐增大
B.元素原子得电子能力逐渐减弱
C.气态氢化物稳定性逐渐增强
D.最高化合价逐渐增高
参考答案:C、N、O、F在周期表相同周期,从左到右原子序数逐渐增大,则
A.同周期元素从左到右原子半径逐渐减小,故A错误;
B.同周期元素从左到右元素的非金属性逐渐增强,得电子能力逐渐增强,故B错误;
C.同周期元素从左到右元素的非金属性逐渐增强,对应的气态氢化物稳定性逐渐增强,故C正确;
D.F的最高化合价为0价,无正价,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 下列关于金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中化合价均不同
D.金属元素所有单质在常温下均为固体
参考答案:A、金属单质在反应中只能失去电子,但处于中间价态的金属离子既有氧化性又有还原性,如亚铁离子既有氧化性又有还原性,故A错误;
B、因金属元素在反应中失去电子,则化合价一定升高,所以金属元素在化合物中一定显正价,故B正确;
C、因绝大数金属元素只有一种正价,则在不同化合物中化合价相同,故C错误;
D、因金属单质Hg在常温下为液体,故D错误;
故选B.
本题解析:
本题难度:一般
5、推断题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。C元素原子核外最外层电子数是其次外层电子数的3倍,D原子比C原子多一个电子层,化合物DC的晶体为离子晶体。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。
请根据以上情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_______________________;DC晶体中结构微粒半径大小比较为__________________;
(2)B的氢化物的分子空间构型是__________________;其中心原子采取__________杂化。
(3)B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高的原因是__________________。
(4)化合物AC2的电子式为__________________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为__________________。
(5)E元素原子的核外电子排布式为____________;ECl3与B、C的氢化物形成的六配位配合物的化学式为__________________。
参考答案:(1)C<O<N;Mg2+<O2-
(2)三角锥形;sp3
(3)NH3分子之间、H2O分子之间都可以形成较强的氢键
(4) ;N2O?
;N2O?
(5)1s22s22p63s23p63d54s1;[Cr(NH3)4(H2O)2]Cl3
本题解析:
本题难度:一般