微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是
A.将NO2和N2O4分子共NA的混合气,气温降至标况下,其体积为22.4L
B.7.8gNa2O2与足量水充分反应转移电子数为0.1NA
C.同温同压下,体积均为11.2L的CO2和SO2所含有氧原子数为NA
D.新戊烷与异戊烷的混合物7.2g中所含共价键为1.6NA
参考答案:BD
本题解析:NO2和N2O4存在化学平衡,2NO2 N2O4。降低温度平衡向正反应方向移动,所以气体的体积减小,A不正确;过氧化钠和水的反应中,过氧化钠既是氧化剂,也是还原剂,只有1个电子。7.8g是0.1mol,B正确;C不正确,因为不一定是在标准状况下;新戊烷和异戊烷互为同分异构体,所以选项D正确,答案选BD。
N2O4。降低温度平衡向正反应方向移动,所以气体的体积减小,A不正确;过氧化钠和水的反应中,过氧化钠既是氧化剂,也是还原剂,只有1个电子。7.8g是0.1mol,B正确;C不正确,因为不一定是在标准状况下;新戊烷和异戊烷互为同分异构体,所以选项D正确,答案选BD。
本题难度:一般
2、填空题 三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为b g·mL-1,则该盐酸的物质的量的浓度是________。
(2)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为________。
(3)FeCl3溶液可以用来净水,其净水的原理为______________________________________(用离子方程式表示),若100mL 2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________0.2NA(填“大于”、“等于”或“小于”)。
参考答案:(1)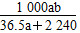 mol·L-1 (2)2 mol·L-1
mol·L-1 (2)2 mol·L-1
(3)Fe3++3H2O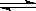 Fe(OH)3(胶体)+3H+ 小于
Fe(OH)3(胶体)+3H+ 小于
本题解析:(1)此题要注意溶液的体积,应用溶液的质量除以溶液密度,且注意溶液密度的单位,计算为: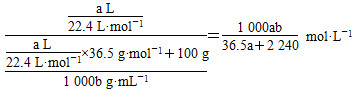 ;(2)根据氧化还原反应的优先规律,氯气先氧化Fe2+,现在溶液中Cl-和Br-的物质的量浓度相等,表明溶液中无Fe2+,有FeBr3、FeCl3,n(Cl-)=3.36 L÷22.4 L·mol-1×2=0.3 mol=n(Br-),根据原子守恒n(Fe3+)=0.2 mol=n(Fe2+),则c(FeBr2)=0.2mol÷0.1 L=2 mol·L-1;(3)Fe3+水解Fe3++3H2O
;(2)根据氧化还原反应的优先规律,氯气先氧化Fe2+,现在溶液中Cl-和Br-的物质的量浓度相等,表明溶液中无Fe2+,有FeBr3、FeCl3,n(Cl-)=3.36 L÷22.4 L·mol-1×2=0.3 mol=n(Br-),根据原子守恒n(Fe3+)=0.2 mol=n(Fe2+),则c(FeBr2)=0.2mol÷0.1 L=2 mol·L-1;(3)Fe3+水解Fe3++3H2O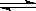 Fe(OH)3(胶体)+3H+生成的Fe(OH)3胶体具有吸附作用,可吸附溶液中的杂质离子,由于Fe3+水解是可逆反应,且生成的Fe(OH)3胶体是分子的集合体,所以生成的Fe(OH)3胶粒的数目小于0.2NA。
Fe(OH)3(胶体)+3H+生成的Fe(OH)3胶体具有吸附作用,可吸附溶液中的杂质离子,由于Fe3+水解是可逆反应,且生成的Fe(OH)3胶体是分子的集合体,所以生成的Fe(OH)3胶粒的数目小于0.2NA。
本题难度:一般
3、选择题 设阿伏加德罗常数的值为NA,下列说法中正确的是
A.17g甲基(—14CH3)所含中子数为9NA
B.常温常压下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA
C.0.1molC5H12分子中含有的C-C键数为0.5NA
D.标准状况下,2.24L辛烷在氧气中完全燃烧生成CO2分子数为0.8 NA
参考答案:B
本题解析:该甲基中中子数是14-6=8,A不正确。乙烯和丙烯的最简式相同,都是CH2,所以B正确。C中应该是0.4NA,不正确,标准状况下,辛烷不是气体,所以正确的答案选B。
本题难度:一般
4、计算题 (6分)已知Cl2在70℃的NaOH溶液中,能同时发生两个反应:
Cl2 + 2NaOH =" NaCl" + NaClO + H2O;3Cl2 + 6NaOH =" 5NaCl" + NaClO3 + 3H2O
反应完后,测得溶液中NaClO和NaClO3的物质的量之比为4∶1。现有49.7g Cl2,将其通入到足量的70℃的NaOH溶液中,充分反应后得500mL溶液。计算完全反应后各生成物的物质的量浓度(不计算水的量)。
参考答案:
c(NaCl)= 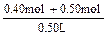 =" 1.80mol/L"
=" 1.80mol/L"
c(NaClO)=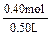 =" 0.80mol/L?" c(NaClO3)=
=" 0.80mol/L?" c(NaClO3)=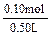 = 0.2来源:91考试网 91ExAm.org0mol/L
= 0.2来源:91考试网 91ExAm.org0mol/L
本题解析:略
本题难度:简单
5、选择题 若以w1和w2分别表示物质的量浓度为c1 mol·L-1和c2 mol·L-1硫酸溶液的质量分数,已知2 w1=w2,则下列推断正确的(硫酸的密度比纯水的大) ( )
A.2c1=c2
B.2c2=c1
C.c2>2c1
D.c1<c2<2c1