微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于化学键的叙述中正确的是
[? ]
A.化学键既存在于相邻原子之间,又存在于相邻分子之间
B.两个原子之间的相互作用叫化学键
C.化学键通常指的是相邻的两个或多个原子之间强烈的相互作用
D.阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列化学用语的表达正确的是( )
A.氯原子的核外电子排布图:

B.氮气分子的电子式:

C.乙炔的结构式:CH≡CH
D.甲烷的球棍模型:

参考答案:A.氯原子质子数为17,核外电子数为17,各层电子数为2、8、7,选项中M容纳8个电子,为氯离子的排布图,故A错误;
B.氮原子为成键的孤对电子对未画出,氮气分子电子式为
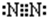
,故B错误;
C.用短线“-”代替共用电子对即为结构式,乙炔分子中氢原子与碳原子之间形成1对共用电子对、碳原子之间形成3对共用电子对,结构式为H-C≡C-H,选项中位子乙炔的结构简式,故C错误;
D.

符合甲烷的分子式CH4,原子之间为单键、空间结构为四面体型,是甲烷的球棍模型,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 .下列说法正确的是:
A.在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性
B.由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物
C.基态C原子有两个未成对电子,所以最多只能形成2个共价键
D.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性
参考答案:A
本题解析:B.HF是共价化合物;电负性判断晶体类型是很笼统的,可能出现很多反例,不过常常可有对应的解释。如HF中,如果H电离成H+,将是一个裸露的质子,吸电子能极强,会导致F-变形,回到共价状态。
C.C原子可以发生杂化,sp3杂化,最多可以形成4个共价键;
D.由于s轨道是球形的,所以当两个s轨道电子形成共价键时,没有方向性。
本题难度:简单
4、选择题 下列电子式或结构式错误的是
[? ]
A.OH-的电子式 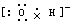
B.NH4Br的电子式 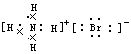
C.CCl4电子式 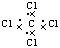
D.H2O的结构式 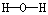
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列含有非极性键的共价化合物是
[? ]
A.?HCl?
B. Na2O2?
C. C2H2?
D. CH4
参考答案:C
本题解析:
本题难度:简单